
分析 (1)除去混入NaCl溶液中少量NaHCO3杂质的试剂是HCl,碳酸氢钠和HCl反应生成氯化钠;
(2)采用加热的方法除去碳酸钠中的碳酸氢钠.
解答 解:(1)除去混入NaCl溶液中少量NaHCO3杂质的试剂是盐酸,碳酸氢钠和HCl反应生成氯化钠,离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:盐酸;HCO3-+H+=CO2↑+H2O;
(2)碳酸氢钠不稳定,受热易分解生成碳酸钠,所以采用加热的方法除去碳酸钠中的碳酸氢钠,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑,故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑.
点评 本题以除杂、物质的用途为载体考查了物质的性质,难点是除杂剂的选取,根据物质和杂质之间的不同点结合物质的性质选取合适的除杂剂,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X、Y、Z三种元素中,X的非金属性最强 | |
| B. | Y的氢化物的稳定性比Z的氢化物弱 | |
| C. | Y的最高正化合价为+7 | |
| D. | X的单质的熔点比Z的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO燃烧的热化学方程为2CO(g)+O2(g)=2CO2(g)△H=+282.8 kJ/mol | |
| B. | H2燃烧的热化学方程为2H2(g)+O2(g)=2H2O(g)△H=-571.6 kJ/mol | |
| C. | 燃烧前混合气体中H2的体积分数为40% | |
| D. | 燃烧后的气体与足量的过氧化钠作用可产生1.50 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
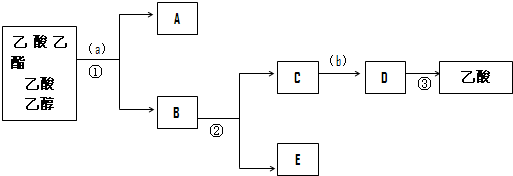
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com