
| A. | 大于10.0mL | B. | 小于10.0mL | C. | 等于10.0mL | D. | 等于11.0mL |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
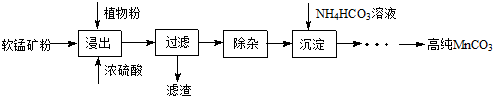
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水润湿的 pH 试纸测量某溶液的 pH | |
| B. | 用量筒量取 20 mL 0.5000 mol/LH2SO4溶液于烧杯中,加水 80 mL,配制成 0.1000 mol/LH2SO4溶液 | |
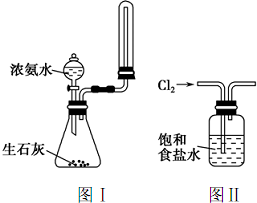
| C. | 实验室用图Ⅰ所示装置制取并收集少量氨气 | |
| D. | 实验室用图Ⅱ所示装置除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、NO3-、Cl- | B. | K+、HCO3-、SO42-、OH- | ||
| C. | ClO-、Cl-、Na+、OH- | D. | Na+、K+、SiO32-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
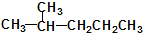 ②
②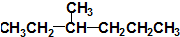 ③
③
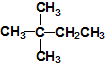 ⑥
⑥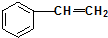
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 以石墨作电极电解氯化铝溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑ | |
| C. | 向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| D. | 向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的网状结构中,由共价键形成的硅原子环中,最小的环上有6个硅原子 | |
| B. | 氯化铯晶体中,Cs+的配位数为8 | |
| C. | 氯化钠晶体中,每个Cl-周围距离相等且最近的Cl-有6个 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| E | A | |||
| B | C | D |
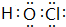 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com