
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
 .
.分析 A、D溶液呈碱性,且A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,则生成的气体为NH3,应是铵盐与碱的反应,由于NH4+离子不与OH-共存,NH4Cl、(NH4)2SO4溶液呈酸性,故A、D有一种为(NH4)2CO3,另外一种为Ba(OH)2或NaOH,B呈酸性,只能为AlCl3、Al2(SO4)3中的一种,而A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,应是氢氧化钡与硫酸铝的反应,则A为Ba(OH)2,B为Al2(SO4)3,D为(NH4)2CO3,C为NaCl,据此解答.
解答 解:(1)A为Ba(OH)2,用电子式表示C为氯化钠,属于离子化合物,电子式表示氯化钠的形成过程为: ,
,
故答案为:Ba(OH)2; ;
;
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解得到碳酸氢钡溶液,由化学式及电离可知c(HCO3-)>c(Ba2+),再由的水解显碱性可知c(OH-)>c(H+),电离产生极少的CO32-,溶液中离子浓度大小:c(HCO3-)>c(Ba2+)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(HCO3-)>c(Ba2+)>c(OH-)>c(H+)>c(CO32-);
(3)③中生成气体的反应为Ba(OH)2与(NH4)2CO3的反应,其离子反应为:Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓,
故答案为:Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)由上述分析可知,C的化学式是:NaCl,故答案为:NaCl,
(4)D为(NH4)2CO3,其溶液显碱性,是因NH4+的水解程度小于CO32-的水解程度,
故答案为:NH4+的水解程度小于CO32-的水解程度.
点评 本题考查物质的推断、离子的共存、盐类水解、常用化学用语等知识,较好的考查学生对知识的运用及分析推理能力,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为297.23 kJ/mol | |
| B. | 形成1 mol SO2的化学键所释放的总能量大于断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量 | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.23 kJ | |
| D. | 1mol SO2的总能量小于 1mol S(s)和1mol O2(g)的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
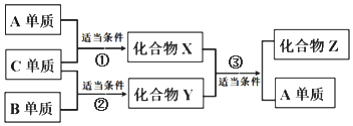 原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族且只有一种金属,D的单质可与热水发生置换反应,所得溶液只能使酚酞变为浅红色;X、Y、Z是由A、B、C组成的二元化合物,其中X常温为液体,且Z可用于配制碳酸饮料.它们之间有如下转化关系,(①②条件为点燃,③为高温、催化剂)下列说法不正确的是( )
原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族且只有一种金属,D的单质可与热水发生置换反应,所得溶液只能使酚酞变为浅红色;X、Y、Z是由A、B、C组成的二元化合物,其中X常温为液体,且Z可用于配制碳酸饮料.它们之间有如下转化关系,(①②条件为点燃,③为高温、催化剂)下列说法不正确的是( )| A. | D单质着火不可以用泡沫灭火器灭火 | |
| B. | 化合物Y和Z均为空气质量日报的主要污染物 | |
| C. | 原予半径:D>B>C>A | |
| D. | 化合物W化学式为B2A4,在一定条件下W可以与X发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单氢化物的稳定性X<Z<W | |
| B. | Y单质在一定条件下可以与氧化铁发生置换反应 | |
| C. | X、Y、W最高价氧化物的水化物两两之间能发生反应 | |
| D. | 室温下,0.1mol/L W的气态氢化物的水溶液的pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学方程式为:CO2+H2$?_{高温}^{催化剂}$ CO+H2O | |
| B. | 恒温下缩小容积,平衡不发生移动,H2的浓度也不变 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的反应热为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水检验CO中是否含有CO2 | |
| B. | 用BaCl2除去NaOH溶液中混有的少量Na2SO4 | |
| C. | 用酒精把碘水中的碘萃取出来 | |
| D. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| B. | 在标况下,22.4LHF和22.4LC2H4原子个数比为1:3 | |
| C. | 6.0gSiO2晶体中含有0.4NA个Si-O键 | |
| D. | 1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl(s)能自发进行,则该反应△H>0 | |
| C. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了c(H+) | |
| D. | 一定条件下,反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com