
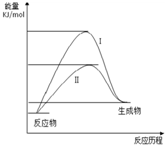
 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液 | B. | 氢氧化钠溶液 | C. | 硫酸钾溶液 | D. | 硝酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10 g H218O中所含的中子数为5NA | |
| B. | 1 mol 铁单质与足量的硫单质充分反应,电子转移数目为3NA | |
| C. | 在1 L 0.1mol/L的NH4Cl溶液中,阴、阳离子总数小于0.2NA | |
| D. | 一定条件下,将1mol N2和3mol H2充分反应,产物分子数目小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
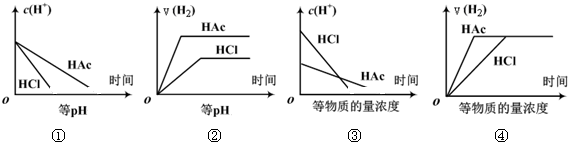
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在溶液中加入盐酸酸化,无现象;再加入BaCl2溶液,如果生成白色沉淀,则原溶液中一定有大量的SO42-存在 | |
| B. | 在溶液中加入AgNO3溶液,生成不溶于硝酸的沉淀,则原溶液中一定有Cl-存在 | |
| C. | 在溶液中加入浓NaOH溶液,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液 | |
| D. | 在溶液中加入KSCN溶液,无现象;再加入稀硝酸,溶液变血红色,则原溶液中一定有Fe2+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | M=WNA | B. | M=$\frac{16w}{b}$ | C. | M=$\frac{w}{16b}$ | D. | M=$\frac{w}{{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
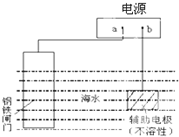
| A. | 图所示是牺牲阳极阴极保护法 | |
| B. | a为电源正极 | |
| C. | 电子流向:a→铁闸门,辅助电极→b | |
| D. | 辅助电极上的反应:O2+2H2O+4e→4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com