
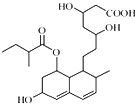
 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 能发生加成、取代,不能消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
分析 该分子中含有酯基、碳碳双键、醇羟基和羧基,具有酯、烯烃、醇、羧酸的性质,能发生水解反应、氧化反应、加成反应、还原反应、酯化反应、取代反应等,据此分析解答.
解答 解:A.不含酚羟基,所以与氯化铁溶液不发生显色反应,故A错误;
B.含有醇羟基、碳碳双键,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故B正确;
C.该分子中含有酯基、碳碳双键、醇羟基和羧基,具有酯、烯烃、醇、羧酸的性质,能发生水解反应、氧化反应、加成反应、还原反应、酯化反应、取代反应等,连接醇羟基碳原子相邻碳原子上含有氢原子,所以能发生消去反应,故C错误;
D.酯基水解生成的羧基及物质本身具有的羧基都能和NaOH反应,1 mol 该物质最多可与2mol NaOH 反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、醇、酯、羧酸的性质,易错选项是A,注意该分子中不含苯环.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | 每一周期的元素都从碱金属开始,最后以稀有气体结束 | |
| B. | 第二、三周期上下相邻的元素的原子核外电子数相差8个 | |
| C. | 只有第2列元素的原子最外层有2个电子 | |
| D. | 元素周期表共有十六个纵行,也就是十六个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、Cl、S、P | B. | K+、Mg2+、Al3+、H+ | ||
| C. | Ca2+、Mg2+、Al3+、K+ | D. | I-、Br-、Cl-、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
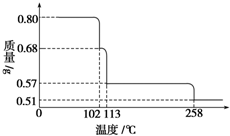 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
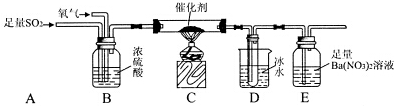
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
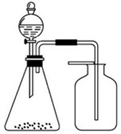
| A. | 浓氨水与固体CaO | B. | 稀盐酸与石灰石 | C. | 稀硝酸与铜片 | D. | 浓盐酸与MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式: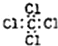 | |
| B. | CH4分子的比例模型 | |
| C. | 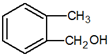 和 和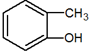 互为同系物 互为同系物 | |
| D. | 稀硝酸银溶液中滴加过量稀氨水,发生反应的离子方程式为Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
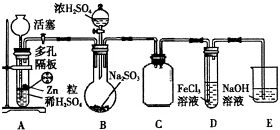
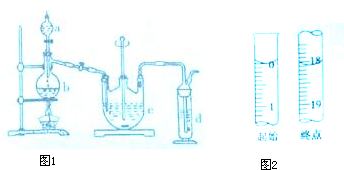 硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
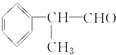 )是一种重要的化工原料,其合成路线如下
)是一种重要的化工原料,其合成路线如下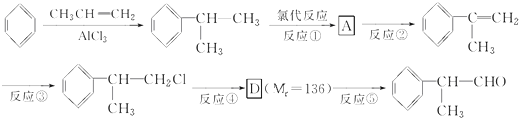
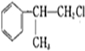 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$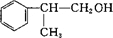 +NaCl.
+NaCl. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$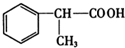 +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
.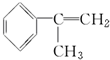 为原料制备
为原料制备 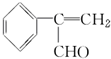 的化学方程式(无机试剂任用).
的化学方程式(无机试剂任用). +Br2→
+Br2→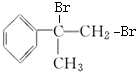 、
、 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$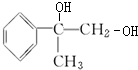 +2NaBr、
+2NaBr、 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O、
+2H2O、 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com