
已知:H+(aq) + OH-(aq) == H2O(l) ;ΔH = -57.3 kJ/mol。
(1)0.1 mol Ba(OH)2配成稀溶液,跟足量的稀硝酸反应,能放出 kJ热量;
(2)用10.0 L 0.10 mol/LCH3COOH溶液与20.0 L 0.10 mol/L NaOH溶液反应,放出的热量
(选填“大于”、“小于”或“等于”)57.3 kJ,理由是 ;
(3)用2 L 0.5 moL/L的H2SO4与1 L 1 mol/L的NaOH溶液反应,放出的热量
(选填“大于”、“小于”或“等于”)57.3 kJ,理由是 。
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
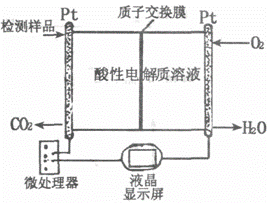
(2)右图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变 D.每消耗 1 mol SO2,同时生成1 mol NO
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为 ;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3===2NaNO2+CO2 2NO2+Na2CO3===NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组化合物中,化学键类型有关叙述正确的是( )
A.CaCl2和Na2O2中都只含有离子键
B.NaOH和NaHS都既含有离子键,又含有极性键
C.CO2和H2S中都只含有非极性键
D.H2O2和CS2都既含有极性键,又含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH为1的H2SO4溶液,下列叙述正确的是 ( )
A.该溶液1 mL稀释至100 mL后,pH等于2
B.向该溶液中加入等体积、pH为13的NaOH溶液恰好完全中和
C.该溶液中H2SO4电离出的c(H+)与水电离出的c(H+)之比为10-12
D.1L该溶液中含有H2SO4分子的物质的量为0.05moL
查看答案和解析>>
科目:高中化学 来源: 题型:
H2和I2在一定条件下能发生反应:H2(g) +I2(g)  2HI(g) △H= -a kJ·mol-1
2HI(g) △H= -a kJ·mol-1
已知:  (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是 ( )
A. 若b>c则相同条件下H2比I2稳定
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入1 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.“钡餐”中使用的硫酸钡是弱电解质
B.太阳能电池板中的硅在周期表中处于金属与非金属的交界位置
C.常用的自来水消毒剂有Cl2和二氧化氯,两者都含极性键
D.“滴水穿石”不涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行反应:2A+3B 2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是
2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是
A.用B表示的反应速率是0.75a mol/(L·min)
B.反应开始时,c(B)=3amol·L-1
C.反应2min后,c(A)=0.5amol·L-1
D.反应2min后,c(B)=1.5amol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)合成氨工业对国民经济和社会发展具有重要的 意义。某合成氨工业中氢气由天然气和水反应制备,其主要反应为:
CH4 (g)+ 2H2O (g) 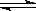 CO2(g)+4H2 (g)
CO2(g)+4H2 (g)
反应过程中能量变化如图所示,则该反应为__________反应(填“吸热”或“放热”)
(2)某温度下,10L密闭容器中充入2mol CH4和 3molH2O(g),发生CH4 (g)+ 2H2O (g) 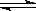 CO2(g)+4H2 (g)反应,反应进行到4s时CO2 的物质的量浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。则:
CO2(g)+4H2 (g)反应,反应进行到4s时CO2 的物质的量浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。则:
①前4s以CH4浓度变化表示的平均反应速率为多少?
② 4s时,混合气体中H2的体积分数为多少?
 ③平衡时,H2O (g)的浓度是多少?(要求:写出计算过程)
③平衡时,H2O (g)的浓度是多少?(要求:写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
三聚氰胺又名蛋白精[分子式:C3N3(NH2)3,相对分子质量:126]是一种低毒性化工产品,婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是 ( )。
A.2.52 g 三聚氰胺含氮原子数目为0.12NA
三聚氰胺含氮原子数目为0.12NA
B.标准状况下1 mol的三聚氰胺的体积为22.4 L
C.三聚氰胺含氮量约为10%
D.三聚氰胺的摩尔质量为126
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com