
| A. | 乙酸和乳酸(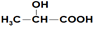 )的混合物共3.0 g,含有的原子总数为0.4 NA )的混合物共3.0 g,含有的原子总数为0.4 NA | |
| B. | 4.6 g乙醇含有-OH数为NA | |
| C. | 1.7 g H2O2中含有的电子数为NA | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
分析 A、乙酸和弱酸的最简式均为CH2O,求出混合物中含有的CH2O的物质的量,然后根据CH2O中含有4个原子来分析;
B、求出乙醇的物质的量,然后根据乙醇中含1个-OH来分析;
C、求出双氧水的物质的量,然后根据双氧水中含18个电子来分析;
D、过氧化钠由2个钠离子和1个过氧根构成.
解答 解:A、乙酸和弱酸的最简式均为CH2O,故3g混合物中含有的CH2O的物质的量为0.1mol,而CH2O中含有4个原子,故0.1molCH2O中含有0.4NA个原子,故A正确;
B、4.6g乙醇的物质的量为0.1mol,而乙醇中含1个-OH,故0.1mol乙醇中含0.1NA个-OH,故B错误;
C、1.7g双氧水的物质的量为0.05mol,而双氧水中含18个电子,故0.05mol双氧水中含有0.9NA个电子,故C错误;
D、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含3NA个离子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 卤代烃和醇都可以发生消去 | |
| C. | 乙烯、聚氯乙烯和苯分子均含有碳碳双键 | |
| D. | 卤代烃、酯及酚均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
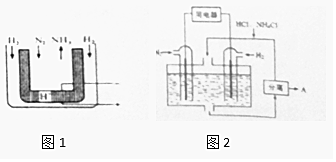 氮及其化合物与人类的生产、生活息息相关.
氮及其化合物与人类的生产、生活息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
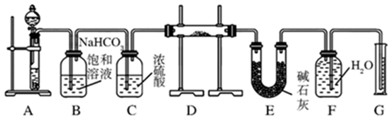
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
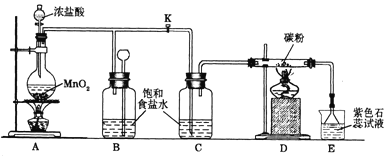
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的失电子能力随着原子序数的增加而减小 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 | |
| D. | 碱金属单质都是强氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
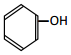 ②
②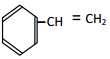 ③
③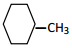 ④
④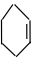 ⑤
⑤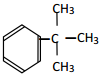 ⑥
⑥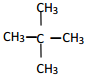
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
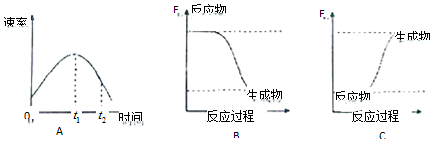
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com