
【题目】某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对X溶液进行如下实验,下列结论正确的是(忽略水的电离,且原溶液中各离子浓度均为0.5mol L-1)

A. 原溶液中一定存在NH4+、Fe2+、SO42-、Cl-
B. 原溶液中可能含有NO3-和Al3+
C. 白色沉淀C可能是Al(OH)3
D. 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
【答案】A
【解析】
该溶液中逐滴加入稀盐酸至过量,无明显现象,说明不含碳酸根离子,并得到X溶液,溶液中加入硝酸钡,产生气体,遇到空气变为红棕色,说明气体为一氧化氮,则溶液有被硝酸根氧化的离子,说明含有亚铁离子,则加入盐酸时不存在氧化还原反应,说明原溶液中不含硝酸根离子。因为不含碳酸根离子,产生白色沉淀,说明含有硫酸根离子,生成了硫酸钡沉淀,溶液A中含有过量的硝酸钡,加入过量的氢氧化钠溶液,产生气体,说明原溶液含有铵根离子,沉淀B为氢氧化铁,溶液B中通入少量的二氧化碳有白色沉淀C,肯定含有碳酸钡沉淀,不能说明是否含铝离子。根据离子浓度相同和溶液中的电荷守恒分析,溶液中还含有氯离子。故含有NH4+、Fe2+、SO42-、Cl-四种离子,则不含有铝离子和钠离子。
A. 根据以上分析可知,原溶液中一定存在NH4+、Fe2+、SO42-、Cl-,故正确;B. 原溶液中不可能含有NO3-和 Al3+,故错误。C. 白色沉淀C是碳酸钡,故错误;D. 沉淀B是Fe(OH)3,故错误。故选A。


科目:高中化学 来源: 题型:
【题目】25 ℃时,Ksp(BaSO4)=1×10-10 mol2·L-2,Ksp(BaCO3)=5.1×10-9 mol2·L-2。在该温度下,下列说法不正确的是( )
A. 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaSO4比BaCO3溶解度更小
B. 若误饮c(Ba2+)=1.0×10-5mol·L-1的溶液时,会引起Ba2+中毒
C. 向同浓度Na2SO4和Na2CO3的混合液中滴加BaCl2溶液,BaSO4先析出
D. 在BaSO4的饱和溶液液中,c(SO42-)=1.0×10-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R、Q原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的0.1mol/L水溶液pH如下表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是

A. W和Q形成的化合物只含有离子键
B. Y和Z的氢化物沸点:Y<Z
C. 离子半径:r(Q>r(R)>r(Z)
D. Y和Q氧化物的水化物酸性:Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
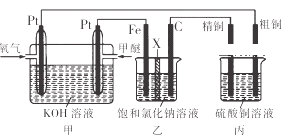
A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe﹣2e ﹣=Fe2+
C. 通入氧气的一极为正极,发生的电极反应为O2﹣4e ﹣+2H2O═4OH﹣
D. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某生产工艺中用惰性电极电解Na2CO3溶液获得NaHCO3和NaOH,其原理如题21图。下列有关说法正确的是

A. a 接外电源负极
B. B出口为H2,C出口为NaHCO3溶液
C. 阳极电极反应为4CO32-+2H2O-4e- = 4HCO3-+O2↑
D. 应选用阳离子交换膜,电解时Na+从右侧往左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10﹣18 | 1.3×10﹣36 | 2.5×10﹣13 |
下列有关说法中正确的是( )
A. 25℃时,CuS的溶解度大于MnS的溶解度
B. 25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10﹣36 molL﹣1
C. 因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D. 除去某溶液中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
Ⅰ.(1)除去NaCl固体中混有的少量KNO3,所进行的实验操作依次为________、蒸发、结晶、________。
(2)除去KCl溶液中的SO42-,依次加入的溶液为(填溶质的化学式)_____________________。
(3)下列物质的分离和提纯方法操作为①花生油、水混合物________;②碘水中的I2________;
Ⅱ.(1)含有6.02×1023个H的H2O,其物质的量是________;1 mol Na2SO4溶于水能电离出______个Na+、______个SO42-。
(2)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(5)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
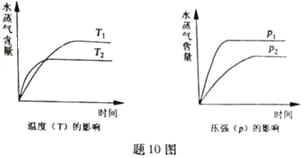
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com