
[化学———物质结构与性质]
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子?
回答下列问题:(答题时,X?Y?Z?Q?R用所对应的元素符号表示)
(1)X元素为 ,X?Y?Z中第一电离能最大的是 ?
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
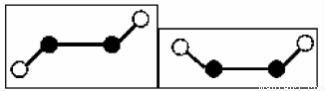
该分子中Y原子的杂化方式是 ?
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法
正确的是 (填正确答案编号)?

A.该晶体属于分子晶体 B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4 D.晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为 ?
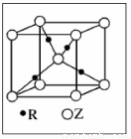
(5)R的基态原子的电子排布式为 ,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为 ,该晶体的密度为a g·cm-3,则晶胞的体积是 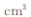 ?
?
(1)C(1分) N(1分) (2)sp2(1分) (3)bcd(1分)
(4)CO(2分)
(5)1s22s22p63s23p63d104s1或[Ar]3d104s1(2分) Cu2O(2分) 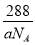 (2分)
(2分)
【解析】
试题分析: X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,核外电子排布为1s22s22p2,则X为C元素;Y的基态原子有7种不同运动状态的电子,则Y为N元素;Z元素在地壳中含量最多,则Z为O元素;Q是电负性最大的元素,则Q为F元素;R+离子只有三个电子层且完全充满电子,离子核外电子排布为1s22s22p63s23p63d10,则R为Cu元素,
(1)由上述分析可知,R为Cu元素,同周期元素从左到右元素的第一电离能呈增大趋势,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O,所以第一电离能从大到小的顺序为:N>O>C,
故答案为:Cu;N;
(2)Y2Q2为N2F2,有如图2种结构,N原子之间形成N═N双键,N与F原子之间形成N-F单键,杂化轨道数=σ键数+孤对电子对数,该分子中N原子的杂化轨道数=2+1=3,所以N原子杂化方式是sp2杂化,
故答案为:sp2杂化;
(3)A.X与Y元素可以形成一种超硬新材料,不可能是分子晶体,由晶体部分结构可知,该晶体为原子晶体,故A错误;
B.C-N键键长比C-C键长短,C-N键键能大,所以晶体的硬度比金刚石还大,故B正确;
C.结构中每个X原子周围有4个Y原子,每个Y原子周围有3个X原子,所以该晶体化学式为X3Y4,即为C3N4,故C正确;
D.该晶体为原子晶体,晶体熔化时共价键被破坏,没有克服范德华力和氢键,故D正确,
故答案为:BCD;
(4)有一种AB型分子与N2分子互为等电子体,它是一种常用的还原剂,其化学式为CO,故答案为:CO;
(5)R为Cu元素,核外有29个电子,其基态原子的电子排布式为1s22s22p63s23p63d104s1,晶胞中Cu原子数目=4、O原子数目= 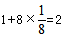 故该晶体的化学式为Cu2O,晶胞质量=
故该晶体的化学式为Cu2O,晶胞质量= 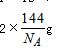 该晶体的密度为ag?cm-3,则晶胞的体积=
该晶体的密度为ag?cm-3,则晶胞的体积= 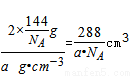
考点: 考查物质结构与性质,涉及元素推断、核外电子排布、电离能、化学键、晶体结构与性质、晶胞计算等,考查学生对信息的理解和知识综合应用的能力,注意利用均摊法进行晶胞计算.


科目:高中化学 来源:2013-2014江西省高一下学期期末考试化学试卷(解析版) 题型:选择题
除去括号内杂质所用试剂和方法,正确的是
A.乙醇(乙酸)、 KOH溶液 、 分液
B.乙烯(SO2) 、 KMnO4溶液 、 洗气
C.乙烷(乙烯)、 H2(催化剂)、 催化加氢
D.乙醇(水)、 CaO 、 蒸馏
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高一下学期期末考试化学试卷(解析版) 题型:选择题
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】
生产自来水的流程图所示。

(1) FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)实验室过滤操作所用到的玻璃仪器是 。
(3)我们有时感觉自来水“有漂白粉的气味”,是因为使用了氯气消毒,请写出有关化学方程下列物质中, (填写序号)可以作为氯气的代用品。
①臭氧 ②NH3(溶液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或 “阳”)。
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH的混合溶液,再加入KI溶液,立即塞好塞子,振荡使其完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.010mol/L Na2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:
2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O
I2+2S2O32-=2I-+S4O62-
水中的溶解氧量为 (以mg·L-l为单位)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )
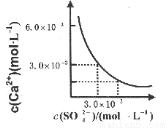
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:简答题
由短周期元素组成的甲?乙和丙均为中学常见物质,一定条件下,存在转化关系:
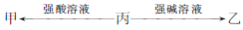
(1)若甲?乙?丙都是单质,甲?乙是同种气体,丙元素的原子结构示意图为 ;丙单质性质活泼,但由其制成的容器可用于储运浓硫酸,原因是 ?工业中制取丙的化学方程式:
(2)若甲?乙是同种有机物,体积分数为75%该有机物的水溶液常用于医疗消毒?写出分子中含有4个碳原子的丙转化为甲的化学方程式:
(3)若甲?乙是不同种气体,乙能使湿润的红色石蕊试纸变蓝?
①写出丙→甲反应的离子方程式: (任写一个)
②0.1mol乙与CuO(s)完全反应,得到一种气态单质?一种固态单质和一种液态化合物,放出14.7kJ的热量?该反应的热化学方程式为 ?
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:选择题
如图所示装置中,a?b都是惰性电极,通电一段时间后(电解液足量),a极附近溶液显红色?下列说法正确的是

A.a是负极,b是正极
B.CuSO4溶液的pH逐渐减小
C.铜电极上的反应式为
D.向NaCl溶液中加入一定量的盐酸,能使溶液与原来溶液完全一样
查看答案和解析>>
科目:高中化学 来源:2013-2014江西八一中学、洪都中学下学期期中考试高一化学试卷(解析版) 题型:选择题
下列说法正确的是
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:选择题
绿色化学要求利用化学反应原理从源头上消除污染。以铜为原料制备硫酸铜,下列四种原理设计,其中最能体现“绿色化学”要求的是
A.Cu +2H2SO4(浓)  CuSO4 +SO2↑+2H2O
CuSO4 +SO2↑+2H2O
B.Cu +Cl2  CuCl2 ,CuCl2+ H2SO4(浓)
CuCl2 ,CuCl2+ H2SO4(浓)  CuSO4 +2HCl↑
CuSO4 +2HCl↑
C.Cu + H2SO4 +H2O2  CuSO4 +2H2O
CuSO4 +2H2O
D. 3Cu +8HNO3=3Cu(NO3)2 +2NO↑+4H2O,Cu(NO3)2+H2SO4(浓)  CuSO4 +2HNO3↑
CuSO4 +2HNO3↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com