
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)==Sn(s)+2CO(g)↑,反应过程中能量的变化如图所示。下列有关该反应的ΔH、ΔS的说法中正确的是
| A.ΔH<0 ΔS<0 | B.ΔH>0 ΔS<0 |
| C.ΔH<0 ΔS>0 | D.ΔH>0 ΔS>0 |
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:单选题
工业上可利用合成气(CO和H2的混合气体)生产甲醇。已知:
CO(g)+2H2(g) CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1
一定条件下,该反应在一体积固定的密闭容器中达到平衡。下列说法正确的是
| A.该反应的△S<0 |
| B.该反应在任何温度下均能自发进行 |
| C.向容器中充入少量He,平衡向正反应方向移动 |
| D.升高温度平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,体积一定的密闭容器中进行可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH > 0,
Z(g)+W(s) ΔH > 0,
下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体密度不变时,反应达到平衡 |
| C.升高温度,Y的百分含量减少 |
| D.平衡后加入X,上述反应的ΔH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
| A.X的转化率为:甲<丙<乙<丁 |
| B.X的转化率为:甲<乙<丙<丁 |
| C.Y的转化率为:甲>丙>乙>丁 |
| D.Y的转化率为:丁>乙>丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实中,能用勒沙特列原理来解释的是
| A.由H2(g)、I2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 |
| B.久置的氯水变成了稀盐酸 |
| C.在FeCl3溶液中加入铁粉防止氧化变质 |
| D.加入催化剂有利于SO2与O2反应制SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)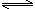 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量akJ |
| ② | 0 | 1 | 3 | 放出热量bkJ |
| ③ | 4 | 0 | 0 | 吸收热量ckJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
恒温、恒容的条件下对于N2(g)+3H2(g) 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
| A.断开一个N≡N键的同时有6个N—H键生成 |
| B.混合气体的密度不变 |
| C.混合气体的压强不变 |
| D.N2、H2、NH3分子数之比为1:3 :2的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,向容积固定且不变的某密闭容器中充入a mol NO2,发生如下反应:
2NO2(g)  N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
| A.平均相对分子质量增大 | B.NO2的转化率提高 |
| C.NO2的质量分数增大 | D.反应放出的总热量大于原来的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com