
| 元 素 | 性 质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
 ; O>S>Al(2)甲酸形成分子间氢键(3)sp2杂化; V形; ①②(4)离子键、共价键(配位键);(5)原子; 酸性; Al3++3H2O
; O>S>Al(2)甲酸形成分子间氢键(3)sp2杂化; V形; ①②(4)离子键、共价键(配位键);(5)原子; 酸性; Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;  。元素的非金属性越强,其失去电子就越难,第一电离能就越大。所以D、E、F三种元素的第一电离能的大小顺序是:O>S>Al.(2)化合物CH2O2为甲酸。其蒸气在293K时理论测算密度为1.9g/L,而由于在甲酸分子之间存在着氢键,所以实际密度为2.5g/L. (3)在SO2中S原子的杂化类型为sp2杂化;分子空间构型为V形;SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3.反应不断消耗SO2也使它不断的溶解。因此SO2易溶于水。(4)化合物NH5可写为NH4H的结构为含有离子键、共价键、配位键的离子化合物。(5)金刚石是原子晶体,硬度大,可制作手表的轴承,由于该物质性质与金刚石相似,所以该晶体类型也是原子晶体。Al2(SO4)3是强酸弱碱盐,水解使溶液显酸性。水解的离子方程式为:Al3++3H2O
。元素的非金属性越强,其失去电子就越难,第一电离能就越大。所以D、E、F三种元素的第一电离能的大小顺序是:O>S>Al.(2)化合物CH2O2为甲酸。其蒸气在293K时理论测算密度为1.9g/L,而由于在甲酸分子之间存在着氢键,所以实际密度为2.5g/L. (3)在SO2中S原子的杂化类型为sp2杂化;分子空间构型为V形;SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3.反应不断消耗SO2也使它不断的溶解。因此SO2易溶于水。(4)化合物NH5可写为NH4H的结构为含有离子键、共价键、配位键的离子化合物。(5)金刚石是原子晶体,硬度大,可制作手表的轴承,由于该物质性质与金刚石相似,所以该晶体类型也是原子晶体。Al2(SO4)3是强酸弱碱盐,水解使溶液显酸性。水解的离子方程式为:Al3++3H2O Al(OH)3+3H+;(6)Fe元素的可用作油漆颜料一种氧化物M为Fe2O3. 它可用作制备一种“绿色”环保高效净水剂K2FeO4。该反应为氧化还原反应。由于Fe的化合价Fe2O3--- K2FeO4从+3---+6,升高3×2,N的化合价KNO3—KNO2从+5—+3.降低2,根据化合价升高与降低的总数相等可知:Fe2O3系数为1,K2FeO4的系数为2,KNO3、KNO2的系数都是3,再结合反应前后各元素的原子个数相等,则由于生成物中含有H、K、O比反应物多可确定反应物还应该有KOH,其系数为4,。水的系数为2.所以该反应的化学方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。
Al(OH)3+3H+;(6)Fe元素的可用作油漆颜料一种氧化物M为Fe2O3. 它可用作制备一种“绿色”环保高效净水剂K2FeO4。该反应为氧化还原反应。由于Fe的化合价Fe2O3--- K2FeO4从+3---+6,升高3×2,N的化合价KNO3—KNO2从+5—+3.降低2,根据化合价升高与降低的总数相等可知:Fe2O3系数为1,K2FeO4的系数为2,KNO3、KNO2的系数都是3,再结合反应前后各元素的原子个数相等,则由于生成物中含有H、K、O比反应物多可确定反应物还应该有KOH,其系数为4,。水的系数为2.所以该反应的化学方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。

科目:高中化学 来源:不详 题型:单选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨气在氧气中燃烧生成氮气 | B.沸点:H2O>NH3 |
| C.NO中N为+2价,氧为-2价 | D.热稳定性:H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫化钾 | B.硫化钠 | C.氯化钠 | D.氧化铝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Fe + 2ZG
Fe + 2ZG 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
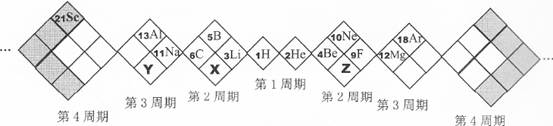
| A.X、Y、Z元素分别为N、P、O |
| B.白格中都是主族元素,灰格中都是副族元素 |
| C.原子半径:Z>X>Y |
| D.X、Y、Z的气态氢化物中最稳定的是:Z的氢化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同主族元素的简单阴离子还原性越强,水解程度越大 |
| B.Na和Cs属于IA族元素,Cs失电子的能力比Na强 |
| C.IA族与VIIA族元素间可形成共价化合物或离子化合物 |
| D.同周期元素(0族元素除外)从左到右,原子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
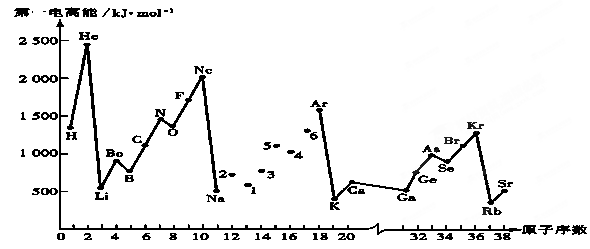
| A.3.5 | B.1.8 | C.2.5 | D.4.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com