
【题目】羟氨![]() 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:![]() ,用0.1mol/L盐酸滴定20mL 0.1mol/L
,用0.1mol/L盐酸滴定20mL 0.1mol/L![]() 溶液,恒定25℃时,滴定过程中由水电离出来的OHˉ浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )
溶液,恒定25℃时,滴定过程中由水电离出来的OHˉ浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )

A.B点对应的溶液中![]()
B.C点对应的溶液中![]()
C.A到C溶液中,![]() 电离常数不变
电离常数不变
D.由A到D,水电离出的![]() 先减小后增大
先减小后增大
【答案】D
【解析】
根据NH2OH在水溶液中的电离方程式可知,滴入盐酸时发生反应NH2OH+HCl=[NH3OH]Cl;水电离出的OHˉ的浓度即为水的电离程度,酸或碱的电离抑制水的电离,盐类的水解促进水的电离,所以HCl和NH2OH恰好完全反应,溶液中的溶质为[NH3OH]Cl时,水的电离程度达到最大,即C点。
A.B点溶液中存在电荷守恒:c(Clˉ)+c(OHˉ)=c(NH3OH+)+c(H+),此时溶液显中性,所以c(OHˉ)= c(H+),所以c(Clˉ)= c(NH3OH+),故A正确;
B.C点HCl和NH2OH恰好完全反应,此时溶液中的溶质为[NH3OH]Cl,根据质子守恒可知c(H+)= c(OHˉ)+ c(NH2OH),故B正确;
C.电离常数只与温度有关,温度不变则电离常数不变,故C正确;
D.据图可知由A到D,水电离出来的OHˉ浓度的负对数先减小后增大,所以水电离出的氢氧根浓度先增大后减小,故D错误;
故答案为D。


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
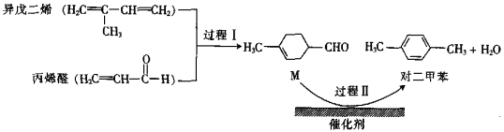
下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取![]() 的绿色方法,原理如图所示(已知:
的绿色方法,原理如图所示(已知:![]() ,
,![]() )。下列说法错误的是( )
)。下列说法错误的是( )
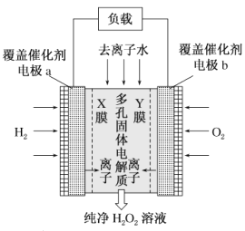
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成![]() 电极上流过
电极上流过![]()
D.b极上的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,见光易分解,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的![]() 。某研究小组以
。某研究小组以![]() (含少量
(含少量![]() )粗品为原料制取CuCl,设计的合成路线如下:
)粗品为原料制取CuCl,设计的合成路线如下:
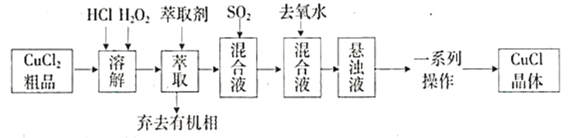
已知:①在较高浓度的盐酸下,![]() 能溶解于甲基异丁基甲酮。
能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:![]()
(1)上述合成路线中,![]() 的作用是________________________,萃取剂为甲基异丁基甲酮,其作用是________________。
的作用是________________________,萃取剂为甲基异丁基甲酮,其作用是________________。
(2)上述合成路线中,![]() 通入混合液的实验装置如图所示:
通入混合液的实验装置如图所示:
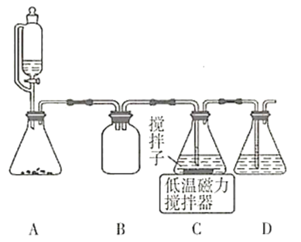
①装置B、D的作用分别是________________________________________________。
②C中反应的离子方程式是___________________________________。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是______________________。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。
干燥时应注意密封、_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素在周期表中的位置如图所示,其中X的简单氢化物水溶液呈碱性。下列叙述中错误的是( )
X | Y | |
Z | W |
A.原子半径:![]()
B.Y和W的最高正价都是+6
C.元素X比元素Z的非金属性强
D.X和Y两种元素能形成多种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图利用培养皿探究氨气的性质,实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象的描述及所做的解释均正确的是
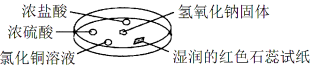
选项 | 实 验 现 象 | 解 释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化铜溶液变白色浑浊 | 白色浑浊的成分是Cu(OH)2 |
D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1,2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1,由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4 的反应。已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1,温度为T时,该反应的热化学方程式为__________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25 ℃,101 kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1 648 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1 2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1 480 kJ·mol-1,FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______。
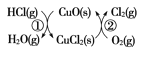
(4)用O2将HCl转化为Cl2,可提高效益,减少污染。 传统上该转化通过如图所示的催化循环实现,其中,反应①为:2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(1)实验一:用如图所示装置制备并收集 NH3。
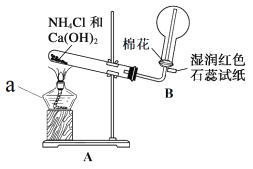
仪器 a 的名称为____________,装置 A 中产生 NH3 的化学方程式为____________, 装置 B 中用圆底烧瓶收集 NH3 的方法为____________(填“向上排空气法”或“向下 排空气法”),当湿润红色石蕊试纸颜色变为____________色,表示已经收集满 NH3。
(2)实验二:用如图所示装置进行 NH3 的喷泉实验。
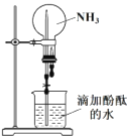
引发该喷泉实验的操作是先____________,再打开止水夹,使烧杯内的水通过导管进入烧瓶形成喷泉,说明 NH3 具有的物理性质是____________,烧瓶内溶液呈红色, 说明 NH3 的水溶液呈____________性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com