
| A. | 酸与碱反应 | B. | 强酸与强碱反应 | ||
| C. | 一元强酸和一元碱反应 | D. | 强酸与强碱反应生成水和可溶性盐 |
分析 离子反应H++OH-→H2O表示强酸与强碱反应生成可溶性盐和水的一类反应,需要明确:酸和碱必须为强电解质,反应生成产物中只有可溶性盐和水,不能生成沉淀或气体,据此进行判断.
解答 解:A.酸或碱若为弱电解质,则离子方程式不能用H++OH-→H2O表示,如硝酸和氨水反应的离子方程式为:NH3•H2O+H+→NH4++H2O,故A错误;
B.强酸与强碱反应中若生成沉淀,不能用H++OH-→H2O表示,如:稀硫酸和氢氧化钡反应生成了硫酸钡和水,反应的离子方程式为:2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O,故B错误;
C.一元强酸和一元碱反应,若碱为弱碱,不能用H++OH-→H2O表示,如盐酸与氨水的反应为:NH3•H2O+H+→NH4++H2O,故C错误;
D.强酸与强碱反应生成水和可溶性盐的反应,都可以用H++OH-→H2O表示,故D正确;
故选D.
点评 本题考查了离子方程的书写,题目难度中等,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,试题有利于培养学生规范答题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 测定某补血剂(成分FeSO4和维生素C)中铁元素的含量,将一定质量的补血剂溶于水,然后用标准浓度的酸性高锰酸钾溶液滴定至溶液恰好变紫色且半分钟不改变 | |
| B. | 测量SO2、N2混合气体中SO2含量,将标准状况下一定体积混合气体通过装有一定浓度一定体积的碘-淀粉溶液的反应直至溶液蓝色恰好消失 | |
| C. | 测定氯化铵与硫酸铵混合物中氯化铵的含量,将一定质量的混合物溶于水,再加入过量氯化钡溶液至沉淀不再生成,过滤、洗涤、干燥,再称重 | |
| D. | 测定硫酸铜晶体(CuSO4•xH2O)里结晶水的含量,将一定质量的硫酸铜晶体加热至蓝色变白,冷却,称量,重复至前后质量恒定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学反应中物质变化的实质是旧化学键断裂和新化学键形成 | |
| B. | 燃烧可看成“储存”在物质内部的能量转化为热能、光能等释放出来 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | B. | 由乙酸制乙酸乙酯 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 甲烷与氯气在光照条件下发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油能使溴的四氯化碳溶液褪色 | |
| B. | 葡萄糖能发生氧化反应和水解反应 | |
| C. | 蔗糖和淀粉都是高分子化合物 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能使pH试纸变红色的溶液中:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
在2L密闭 容器中,加入X和Y各4mol,一定条件下发生化学反应:
容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g) Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是
Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是
A.5s时,正、逆反应速率都达到最大
B.前5s 内平均反应速率υ(Y)= 0.1 mol/( L·s)
内平均反应速率υ(Y)= 0.1 mol/( L·s)
C.达平衡时,各物质的浓度都保持不变,反应停止
D.升高温度,测得容器中密度不变时,表示该反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
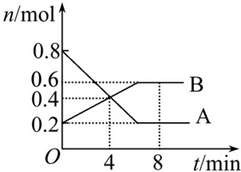 8min时,v(正)=v(逆).
8min时,v(正)=v(逆).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com