
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
【答案】D
【解析】试题分析:A、CH3COOH属于弱酸,抑制水的电离,加入NH3·H2O,消耗CH3COOH,水的电离程度增大,但氨水过量后,对水电离抑制,故错误;B、当向CH3COOH溶液中滴加相同浓度的NH3·H2O,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh=[c(H+)×c(NH3·H2O)]/c(NH4+),随着氨水的加入,c(H+)逐渐减小,Kh不变,因此c(NH4+)/c(NH3·H2O)变小,当氨水至溶液显碱性时,氨水的电离常数Kb=[c(OH-)×c(NH4+)]/c(NH3·H2O),随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+)/c(NH3·H2O)变小,因此此比值始终变小;C、根据物料守恒,n(CH3COOH)+n(CH3COO-)=0.001mol,由于溶液体积逐渐增大,因此c(CH3COOH)和c(CH3COO-)之和逐渐减小,故错误;D、当加入氨水的体积为10mL,醋酸和NH3·H2O物质的量相等,由于二者电离常数相等,因此溶液显中性,c(H+)=c(OH-),根据电荷守恒,c(NH4+)=c(CH3COO-),故正确。
考点:考查电离平衡常数、水解平衡常数、离子浓度大小比较等知识。
【题型】单选题
【结束】
13
【题目】常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
【答案】D
【解析】①(NH4)2Fe(SO4)2溶液中Fe2+的水解对于铵根离子的水解起到抑制作用, ②(NH4)2CO3 中碳酸根离子水解对于铵根离子的水解起到促进作用,③(NH4)2SO4溶液中硫酸根离子对铵根离子的水解无影响,所以溶液中铵根离子的水解程度的大小顺序为:②>③>①。则要达到相同的铵根离子浓度,水解程度大的溶液,物质的浓度应该越大,即溶液浓度由大到小的顺序是:②>③>①。选项A错误。由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,由于醋酸的浓度远大于氢氧化钠的浓度,所以中和以后得到醋酸钠(较少)和醋酸(较多)的混合溶液,溶液显酸性,即c(H+)>c(OH-),根据电荷守恒得到:c(CH3COO-)>c(Na+)。又因为钠离子是醋酸钠完全电离生成的,氢离子使醋酸微弱电离得到的,所以有c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。选项B错误。pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合,两溶液的氢氧根离子和氢离子的浓度刚好相等,等体积混合,恰好中和,溶液显中性。选项C错误。pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,其![]() ,所以
,所以![]() ,
, ![]() ,选项D正确。
,选项D正确。


科目:高中化学 来源: 题型:
【题目】下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是

A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于1.5mol氢气的叙述错误的是( )
A.体积是33.6LB.质量是3g
C.所含电子的物质的量是3molD.氢原子数目约为3×6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_____________________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为______________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是____________;若反应方程式中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )
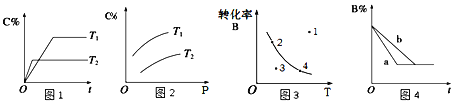
A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
【答案】C
【解析】A. 由图1可知,T2时达到平衡所需时间短,所以T1<T2,升温平衡左移,该反应正反应为放热反应,故A错误;B. 由图2可知,加压平衡右移,说明该反应m+n>p,故B错误;C. 图3中,温度一定,点3达到平衡的过程中B减少,V正>V逆,故C正确;D. 图4中,若m+n=p,加压平衡不移动,则a曲线可能为加压,故D错误。故选C。
点睛:在分析本题图1和图4一类涉及影响反应速率条件的图像时,注意把握图像的关键内容—斜线的斜率,斜率越大,反应速率越大,对应的是有利于增大反应速率的条件。
【题型】单选题
【结束】
11
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)![]() 3Z(g)+Q(s) △H >0,下列叙述正确的是
3Z(g)+Q(s) △H >0,下列叙述正确的是
A. 当容器中X与Y的物质的量的比满足1:2时反应达到平衡
B. 达到平衡时X的转化率为25%,则平衡常数K值为9/4
C. 达到平衡后,反应速率2V正(Y)="3" V逆(Z)
D. 达到平衡后,加入Q,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要使用玻璃棒,其中玻璃棒作用相同的是( )
①过滤;②蒸发;③溶解;④向容量瓶中转移液体.
A.①和④
B.①和③
C.③和④
D.①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是
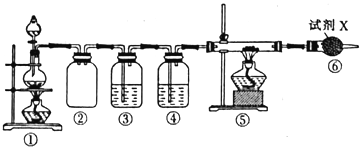
A. ①中发生的化学反应为NaNO2+NH4Cl![]() NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
B. ④、⑥中依次盛装的试剂可以是浓H2SO4、碱石灰
C. ③中盛放的试剂是NaOH 溶液
D. 实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮的氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理。可实现绿色环保、低碳减排、废物利用等目的。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g)=CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 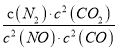 ,请写出此反应的热化学方程式_________。
,请写出此反应的热化学方程式_________。
(2)脱硝
利用甲烷与NO2反应,生成无污染的物质,则该反应的化学方程式为:___________。
(3)脱碳
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图1),则上述CO2转化为甲醇反应的△H3_____0(填“>”、“<”或“=”)。
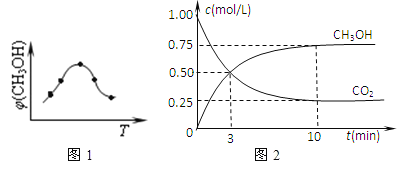
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.请回答:第10min后,若升温,该反应的平衡常数将_____(填“变大”、“变小”、“不变”);若向该容器中再充入1molCO2和3molH2再次达到平衡时,则CH3OH(g)的体积分数将___(“变大”、“变小”、“不变”)。
(4)脱硫
某种脱硫工艺中将废气经处理后,与一定量的氨气、潮湿的空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由大到小的顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室常用排饱和食盐水的方法收集氯气
B. 在硫酸亚铁溶液中,加入铁粉以防止氧化
C. 酯在碱性条件下水解的程度较为完全
D. 氨水应密闭保存,放置低温处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com