
| A. | NaOH溶液中混有Ba(OH)2 (CuSO4) | B. | Cu(NO3)2中混有AgNO3 (Cu粉) | ||
| C. | CO中混有CO2(炽热的炭) | D. | CO2中混有HCl气体 (NaOH溶液) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn与盐酸反应 | B. | CaO与H2O反应 | C. | NaOH与盐酸反应 | D. | C和H2O(g)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$Na2CO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
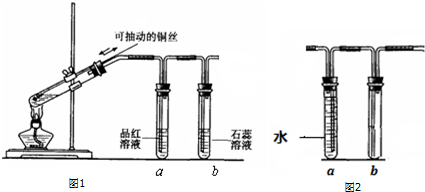 几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设
几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 垃圾处理常用的方法是卫生填埋、焚烧、堆肥 | |
| B. | 将垃圾分类回收是垃圾处理的发展方向 | |
| C. | 填埋垃圾不需处理,只深埋即可 | |
| D. | 焚烧垃圾产生大量污染空气的物质,故不易采用此方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向碳酸钠溶液中滴入几滴酚酞溶液 | 证明碳酸钠溶液呈碱性 |
| B | 取少量未知溶液于一只干净的试管中,向该溶液中逐渐滴入NaOH溶液直至过量 | 检验该溶液中是否含有Al3+ |
| C | 取未知溶液做焰色反应实验,并通过蓝色钴玻璃观看 | 检验该溶液中是否含有K+ |
| D | 取少量未知溶液,滴加新制的氯水,再滴加KSCN溶液 | 检验未知液中是否含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
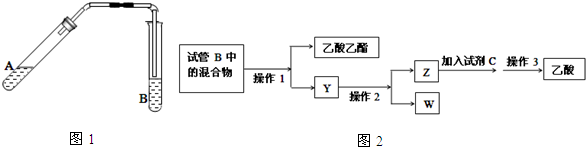
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
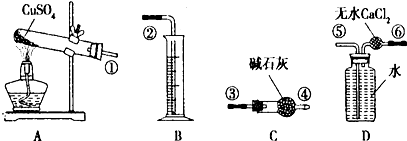
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com