
甲烷在高温下与水蒸气反应,反应方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g).部分物质的燃烧热数据如下表:
CO(g)+3H2(g).部分物质的燃烧热数据如下表:
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量.写出CH4和H2O(g)在高温下反应的热化学方程式________.
科目:高中化学 来源: 题型:阅读理解
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 NH3H2O+H+
NH3H2O+H+ NH3H2O+H+
NH3H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.| 4xV2 |
| 27n2(1-x)4 |
| 4xV2 |
| 27n2(1-x)4 |
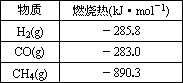
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | △H(kJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
| 4n |
| 4n-2na |
| 4n |
| 4n-2na |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
 H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发
H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com