莫尔法是实验室和工业生产中常用的一种测定氯离子含量的滴定分析手段,以AgNO
3标准溶液为滴定剂、K
2CrO
4为指示剂,于中性或弱碱性溶液中测定Cl
-的分析方法.它是利用加入的银离子能与氯离子反应产生沉淀,当氯离子完全反应时(化学上一般认为离子浓度小于10
-5mol/L时,沉淀就达完全),会与指示剂反应,产生有色沉淀,表明达到滴定终点.某化学兴趣组同学用该法测定工业盐中NaCl的含量.
通过查阅资料,同学们知道了3种物质的溶度积:
AgNO
2(淡黄色)Ksp=6.0×10
-4;
AgCl(白色)Ksp=2.0×10
-10;
Ag
2CrO
4(砖红色) Ksp=2.0×10
-12.
实验步骤如下:
①取m g样品溶于约50mL蒸馏水,定容至250mL
②准确移取25.00mL溶液于锥形瓶中,加入适量稀硝酸酸化
③选用合适氧化剂做适当处理
④除去过量的氧化剂
⑤
⑥用浓度为c mol/L的标准AgNO
3滴定,记下消耗的AgNO
3体积
⑦平行测定3次,平均消耗AgNO
3V mL
请根据以上描述,回答下列问题:
(1)依次写出滴定过程中发生反应的离子方程式:
(2)滴定前为什么要用氧化剂做预处理?
(3)用氧化剂处理时,可以选用的氧化剂有
A、KMnO
4 B、K
2Cr
2O
7 C、H
2O
2 D、KClO
3(4)写出实验步骤⑤
(5)滴定时指示剂的浓度将会影响测定结果,试利用所学知识,计算锥形瓶中K
2CrO
4的浓度应该控制在
mol/L为宜.
(6)写出样品中NaCl含量的计算式
(7)测定工业盐中氯化钠含量的方法还有很多,请简述一种不同的测定方法
.(只要答出简要方法,详细的实验步骤不作要求)



 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
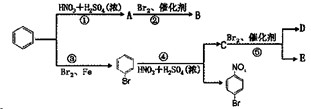
 ,-R等可使新导入的取代基进入苯环的邻位和对位;第二类取代基如-NO2,-SO3H,-CHO等可使新导入的取代基进入苯环的间位.现有如图所示的转化关系;(每一步反应都只导入一个取代基)
,-R等可使新导入的取代基进入苯环的邻位和对位;第二类取代基如-NO2,-SO3H,-CHO等可使新导入的取代基进入苯环的间位.现有如图所示的转化关系;(每一步反应都只导入一个取代基)