
����Ŀ��I.����A������Ԫ����ɵĻ����Ϊ̽������A����ɣ���Ʋ������ʵ�飺
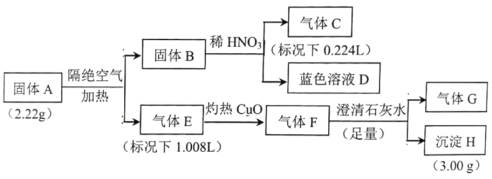
��֪������B��һ�ֵ��ʣ�����E��F����G������һ��������ɡ�
��ش�
��1�����A������Ԫ����__________������E��__________��
��2������A�����������ȷֽ�Ļ�ѧ����ʽ��__________��
��3����ɫ��ҺD���Ҵ���Ӧ�ɻ�ù���A��ͬʱ������һ�ֳ������������壬�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
��.ij��ѧ��ȤС��Ϊ̽��SO2��![]() ��Һ�ķ�Ӧ��������װ�ã��г֡����������ԣ�����ʵ�飺�Ʊ�SO2����SO2ͨ��
��Һ�ķ�Ӧ��������װ�ã��г֡����������ԣ�����ʵ�飺�Ʊ�SO2����SO2ͨ��![]() ��Һ�У�Ѹ�ٷ�Ӧ���õ���ɫ������Һ�Ͱ�ɫ������
��Һ�У�Ѹ�ٷ�Ӧ���õ���ɫ������Һ�Ͱ�ɫ������
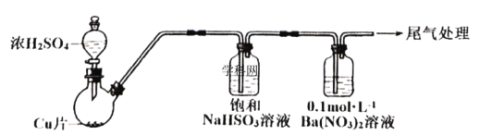
��1��SO2ͨ��![]() ��Һ�У��õ���ɫ������Һ�Ͱ�ɫ���������ӷ���ʽ��__________��
��Һ�У��õ���ɫ������Һ�Ͱ�ɫ���������ӷ���ʽ��__________��
��2����ͨ��![]() ��Һ�е�SO2�ѹ����������ʵ�鷽������__________��
��Һ�е�SO2�ѹ����������ʵ�鷽������__________��
���𰸡�Cu��C��N��O CO��N2 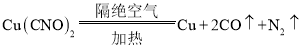
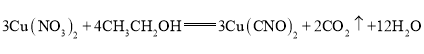
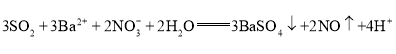 ��SO2���㣩��
��SO2���㣩��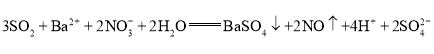 ��SO2������ ȡ������Ӧ�����Һ���Թ��У����뼸�����Ը��������Һ������ɫ��˵��ͨ���SO2�ѹ��������������𰸼��ɣ�
��SO2������ ȡ������Ӧ�����Һ���Թ��У����뼸�����Ը��������Һ������ɫ��˵��ͨ���SO2�ѹ��������������𰸼��ɣ�
��������
I������B��ϡHNO3��Ӧ��������C����ɫ��ҺD��֪������BΪCu��DΪCu(NO3)2��CΪNO����n(NO)=![]() =0.01mol����3Cu~2NO�ɵã�n(Cu)=
=0.01mol����3Cu~2NO�ɵã�n(Cu)=![]() =0.015mol��m(Cu)=0.015mol��64g/mol=0.96g��
=0.015mol��m(Cu)=0.015mol��64g/mol=0.96g��
����E������CuO��Ӧ��������F��������F����SO2��F�ͳ���ʯ��ˮ��Ӧ�г���H���ɣ���HΪCaCO3��F��CO2��E��CO����n(CaCO3)=![]() =0.03mol����Cԭ���غ�ɵã�E��n(CO)=0.03mol��m(CO)=0.03mol��28g/mol=0.84g��
=0.03mol����Cԭ���غ�ɵã�E��n(CO)=0.03mol��m(CO)=0.03mol��28g/mol=0.84g��
����A�����������ȵõ�Cu��CO��������G�����ԣ�m(G)=2.22g-0.84g-0.96g=0.42g����������E�����Ϊ1.008L�ɵã�����n(G)=![]() =0.015mol����M(G)=
=0.015mol����M(G)=![]() =28g/mol�����ԣ�GΪN2��A�У�n(N)=0.015mol��2=0.03mol����A��Cu��C��O��N�����ʵ���֮��=0.015mol:0.03mol:0.03mol:0.03mol==1:2:2:2����AΪCu(CNO)2��
=28g/mol�����ԣ�GΪN2��A�У�n(N)=0.015mol��2=0.03mol����A��Cu��C��O��N�����ʵ���֮��=0.015mol:0.03mol:0.03mol:0.03mol==1:2:2:2����AΪCu(CNO)2��
��SO2�н�ǿ��ԭ�ԣ���ͨ����Һ�п�ʹ��Һ�����ԣ�NO3-��������������ǿ�����ԣ���SO2ͨ��Ba(NO3)2�з���������ԭ��Ӧ���ݴ˽��
I��(1)�ɷ�����֪��A�к�Cu��C��N��O����Ԫ�أ�����EΪCO��N2�Ļ����ʴ�Ϊ��Cu��C��N��O��CO��N2��
(2)���ԭ���غ��д����A�����������ȵĻ�ѧ����ʽΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(3)���ԭ���غ㡢��ʧ�����غ��д��Cu(NO3)2���Ҵ���Ӧ�Ļ�ѧ����ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��(1)SO2����ԭ������������SO42-��Ba2+��SO42-��ϳ�BaSO4��NO3-��������������ԭΪNO����SO2����������������ΪBaSO4����SO2���������������BaSO4�H2SO4�����ԭ���غ㡢����غ㡢���ӵ�ʧ�غ�ɵ�SO2ͨ��BaNO3)2��Һ�з����ķ�Ӧ�����ӷ���ʽΪ��![]() (SO2����)��
(SO2����)��![]() (SO2����)���ʴ�Ϊ��
(SO2����)���ʴ�Ϊ��![]() (SO2����)��
(SO2����)��![]() (SO2����)��
(SO2����)��
(2)��ͨ��Ķ��������������Һ�н���SO2����Һ�����л�ԭ�ԣ���ʹKMnO4��Һ��ǿ��������ɫ����˿�ȡ������Ӧ�����Һ���Թ��У����뼸�����Ը��������Һ������ɫ��˵��ͨ���SO2�ѹ������ʴ�Ϊ��ȡ������Ӧ�����Һ���Թ��У����뼸�����Ը��������Һ������ɫ��˵��ͨ���SO2�ѹ��������������𰸼��ɣ���


 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������Ҫ22.4L(��״��)SO2���塣��ѧС��ͬѧ���ݻ�ѧ����ʽZn+2H2SO4(Ũ)=ZnSO4+SO2��+2H2O�����,ȡ65.0gп����98%��ŨH2SO4(��=1.84g/cm3)110mL��ַ�Ӧ,пȫ���ܽ�,�����Ƶõ�����,��ͬѧ��Ϊ���ܻ������ʡ�
(1)��ѧС�����Ƶõ������л��е���Ҫ�������������_______(�����ʽ)���������ֽ������Ҫԭ����_______________________(�û�ѧ����ʽ�ͱ�Ҫ�����ּ���˵��)��
(2)Ϊ֤ʵ��ط���,��ѧС���ͬѧ�����ʵ��,��װ������װ��,������ȡ���������̽����

��װ��B�м�����Լ�_______,��Ӧ�����ӷ���ʽ��______________��
��װ��D������Լ�������_______,װ��F������Լ��Լ�������_______��
�ۿ�֤ʵһ������п����һ������Ũ���ᷴӦ�����ɵ������л���ij���������ʵ��������______________����U�ι�G������Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����������������ԭ�����͵���
A.����ˮ�д�������ƽ�⣺Br2��H2O![]() HBr��HBrO��������NaOH��Һ����ɫ��dz
HBr��HBrO��������NaOH��Һ����ɫ��dz
B.���ڷ�Ӧ��2HI(g)![]() H2(g)+I2(g)��ʹƽ����ϵ��С�������ѹǿ����ɫ����
H2(g)+I2(g)��ʹƽ����ϵ��С�������ѹǿ����ɫ����
C.Fe(SCN)3��Һ�м������KSCN����ɫ����
D.�غ�ɫ����NO2��2NO2![]() N2O4����С�����ѹ����ɫ�ȱ�����dz
N2O4����С�����ѹ����ɫ�ȱ�����dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��1L���ܱ������У�����2molA��1molB������������Ӧ��2A(g)+B(g)![]() 3C(g)+D(g)�ﵽƽ��ʱ��C��Ũ��Ϊ1.2mol/L��C���������Ϊa%��ά��������ѹǿ���¶Ȳ��䣬�����������Ϊ��ʼ���ʣ��ﵽƽ���C��Ũ��������1.2mol/L����
3C(g)+D(g)�ﵽƽ��ʱ��C��Ũ��Ϊ1.2mol/L��C���������Ϊa%��ά��������ѹǿ���¶Ȳ��䣬�����������Ϊ��ʼ���ʣ��ﵽƽ���C��Ũ��������1.2mol/L����
A.3mol C+1mol DB.1mol A+0.5mol B+1.5mol C+0.5mol D
C.1mol A+0.5mol B+1.5mol CD.4molA+2mol B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飺���������ۻ���ֹͣ���Ȳ�ͨ���������ƾ���ȼ�ղ����ɴ������̡����������������
![]()
A. ���Ż�ȼ�ղ�����ɫ����
B. ��Ӧ���ɵĴ����������Ȼ��ƹ���С����
C. �������Ļ�ѧ��Ӧ�ǣ� Cl2+2NaOH=NaCl+NaClO+H2O
D. ���������Ҳ���ʪ��ĵ��۵⻯����ֽ�ж������Ƿ�Һ��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.NOx��CO��SO2�ȴ�����Ⱦ����Ĵ�������������������о����ȵ����⡣
��1����֪��
a.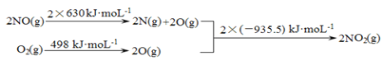
b.2NO��g����O2��g��![]() 2NO2��g�� ��H1
2NO2��g�� ��H1
2SO2��g����O2��g��![]() 2SO3��g�� ��H2=��196.6 kJ��mol-1
2SO3��g�� ��H2=��196.6 kJ��mol-1
����H1 =___kJ��mol-1��
��д��NO2������SO2���巴Ӧ����SO3�����NO������Ȼ�ѧ����ʽ____��
��2��ú̿ȼ�չ����в�����CO�ֻ���CaSO4������ѧ��Ӧ������������Ч�ʡ�������������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��Ӧ��CaSO4��s����CO��g��![]() CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
CaO��s����SO2��g����CO2��g�� ��H1��+218.4 kJ��mol-1
��Ӧ��CaSO4��s����4CO��g��![]() CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
CaS��s����4CO2��g�� ��H2��-175.6 kJ��mol-1
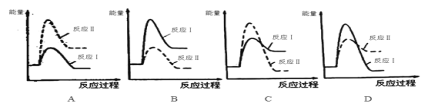
�����ϣ��ٷ�Ӧ��ͷ�Ӧ��ͬʱ�������ڷ�Ӧ������ʴ��ڷ�Ӧ������ʣ�
��ش��������⣺
�����з�Ӧ���������仯ʾ��ͼ��ȷ����____��
��.���淴ӦmA(g)��nB(g)![]() pC(g)��gD(g)��v��tͼ����ͼ����ʾ���������������䣬ֻ�ڷ�Ӧǰ������ʵĴ�������v��tͼ��������ʾ������˵����ȷ����___��
pC(g)��gD(g)��v��tͼ����ͼ����ʾ���������������䣬ֻ�ڷ�Ӧǰ������ʵĴ�������v��tͼ��������ʾ������˵����ȷ����___��
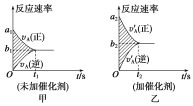
��a1��a2 ��a1��a2 ��b1��b2 ��b1��b2 ��t1��t2 ��t1��t2 ����ͼ����Ӱ���������� ��ͼ������Ӱ�����������
��.��0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H��0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����
2NH3(g) ��H��0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����
T/�� | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
��ش�����������
���ԱȽ�K1��K2�Ĵ�С��K1____K2(�������=������)��
��400��ʱ����Ӧ2NH3(g)![]() N2(g)+3H2(g)��ƽ�ⳣ��KΪ____�������NH3��N2��H2��Ũ�ȷֱ�Ϊ3molL1��2molL1��1molL1ʱ����÷�Ӧ��v��(N2)___v��(N2)(�������=������)��
N2(g)+3H2(g)��ƽ�ⳣ��KΪ____�������NH3��N2��H2��Ũ�ȷֱ�Ϊ3molL1��2molL1��1molL1ʱ����÷�Ӧ��v��(N2)___v��(N2)(�������=������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ�������
A.���۷���ϡ������Һ��2Fe+6H+�T2Fe3++3H2��
B.��NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH4++OH��![]() NH3��+H2O
NH3��+H2O
C.ʯ��ʯ��ϡ���ᷴӦ��CO32��+2H+�T CO2��+H2O
D.Cl2ͨ��ˮ�У�Cl2+H2O = H++Cl��+HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO���黯��ӦΪ��CO(g)+3H2(g)=CH4(g)+H2O(l)����ͼ��ʹ��ij�ִ���ʱת�������е������仯����������ʡ�ԣ������в���ڷ�Ӧ����������
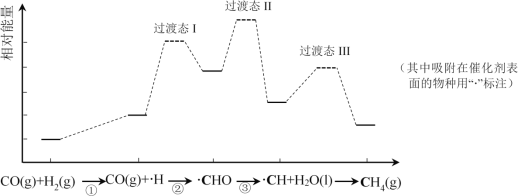
����˵������ȷ���ǣ� ��
A.�����ֻ�зǼ��Լ�����
B.���������������ԭ��������������
C.�������Ҫ��������
D.ʹ�øô���������Ч���CO��ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ�����˵����ȷ����
A. �����ڿ��������ȿ����ۻ��һᷢ������ȼ��
B. ![]() �ڿ�����ȼ�գ�������ɫ���棬���ɰ�ɫ����
�ڿ�����ȼ�գ�������ɫ���棬���ɰ�ɫ����
C. ����ˮ������Ӧ�IJ����Ǻ�ɫ��![]()
D. ���Ʋ;߲�������ʢװ���ԡ����Խ�ǿ��ʳ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com