
【题目】检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( )
A.稀硝酸B.KSCN溶液C.溴水D.酸性KMnO4溶液
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为_________、_________;滤渣①的主要成分为__________。

(2)Co2O3与浓硫酸反应生成CoSO4,化学方程式为______________________________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,离子方程式为____________________________________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____________mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11,Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________。
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率=![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量为Mg·mol-1的气态化合物VL (已换算成标准状况) 溶于mg 水中,得到溶液的溶质质量分数为ω%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法正确的是( )
A. M 可表示为![]() B. c 可表示为
B. c 可表示为![]()
C. ω%可表示为![]() D. ρ可表示为
D. ρ可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是()
A. 铁在潮湿空气中生锈是自发过程
B. 电解池的反应是属于自发反应
C. NH4NO3溶于水吸热,说明其溶于水不是自发过程
D. 非自发反应在任何条件下一定都不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、![]() 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
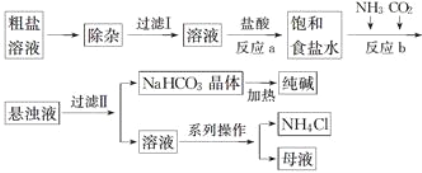
A. 在“侯氏制碱法”中涉及到了氧化还原反应
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 工艺中只有碳酸氢钠加热分解产生的CO2可回收循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫铁矿烧渣(主要含 Fe2O3、SiO2 等)制备碱式硫酸铁[Fea(OH)b (SO4)c]溶液, 并测定其组成。

(1)酸浸时反应的化学方程式为___。
(2)操作 a 的名称为___,X 为___(填化学式)。
(3)加 CaCO3 调节溶液的 pH,其目的是中和溶液中的酸,并使 Fe2(SO4)3 转化为 Fea(OH)b (SO4)c。若溶 液的 pH 偏高,将会导致溶液中铁元素的含量降低,其原因是___(用文字表述)。
(4)为测定碱式硫酸铁的组成,取一定量样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的 BaCl2 溶液,得到白色沉淀 1.7475 g。另一份溶液,先将 Fe3+还原为 Fe2+,充分反应后向溶液中滴加 0.02000 mol·L-1 K2 Cr2O7溶液,完全反应时消耗K2 Cr2O7溶液 50.00 mL。求该样品的化学式(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)__________________。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的单质, 其中一种是常见金属,通常状况下,A为固体,B为深红棕色液体,C为气体,其余均为化合物,X是一种具有挥发性的无氧强酸,E为黑色晶体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。

(1)在反应①~⑦中,不属于氧化还原反应的是______ (填序号)。
(2)G溶液与氯气按物质的量1∶1反应的离子方程式:________ 。
(3)反应⑦的化学方程式为 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)

(1)若A是一种黄色单质固体,则B→C的化学方程式为_______________。浓的D溶液使纸张变黑体现了它的___________性。
(2)若C是红棕色气体,则A化学式可能_________;写出稀的D溶液与铜反应的离于方程式___________________________________________。
(II)工业上治炼铝的原料是铝土(主要成分是A12O3,杂质为Fe2O3、FeO、SiO2等)。某研究小阻设计的提纯A12O3的方案如下

(3)滤液2中含有的溶质有NaOH、______和______(填化学式)。
(4)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2被空气氧化,写出其被氧化的化学方程式___________________________。
(5)写出通入过量CO2生成沉淀A时反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCO3是生产补血剂的原料。资料显示:FeCO3是难溶于水的白色固体,不同条件下煅烧可得到不同的铁的氧化物。
(1)在物质的分类中,FeCO3属于_________(选填序号)。
a. 碳酸盐 b. 亚铁盐 c. 难溶盐
(2)验证FeCO3的性质,进行如下实验:
实验一:Ⅰ. 向FeCO3固体中加入蒸馏水,固体未见明显减少;一段时间后,难溶物上方出现红褐色物质。
Ⅱ. 向FeCO3固体中加入稀硫酸,固体溶解并产生无色气体,溶液为浅绿色;向浅绿色溶液中加入KSCN溶液,溶液不变红。
①根据Ⅰ,完成下列方程式并配平:4FeCO3+__________+___________=Fe(OH)3+4CO2
②Ⅱ中,反应的离子方程式是_______________。
实验二:
FeCO3![]() 固体A
固体A![]() 溶液甲
溶液甲![]() 红色溶液乙
红色溶液乙
③由实验流程推知,煅烧的另一产物及固体A的组成分别是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com