
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
| 生 成 物 | 水溶性Cu/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
| 酸溶性Fe/% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 | |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.氯化铝 | B.硫酸铜 | C.硝酸钠 | D.稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+ 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
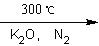 (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。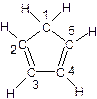 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),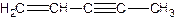 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________; (2)实验中观察到的主要现象是:
(2)实验中观察到的主要现象是: ①_______________________________ ;
①_______________________________ ; ②_______________________________ ;
②_______________________________ ; ③_______________________________ ;
③_______________________________ ; ④_______________________________ 。
④_______________________________ 。 (3)用该装置做铜与浓硝酸反应实验的优点:______________ ;
(3)用该装置做铜与浓硝酸反应实验的优点:______________ ; (4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。
(4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com