
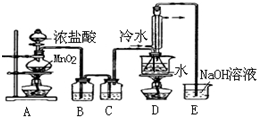
| A. | 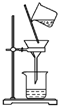 除去粗盐溶液中的不溶物 | B. | 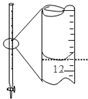 记录滴定终点读数为12.20ml | ||
| C. | 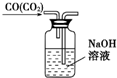 除去CO气体中的CO2气体 | D. | 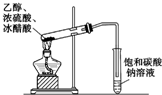 乙酸乙酯制备演示实验 |
分析 A.除去粗盐溶液中的不溶物用过滤方法分离;
B.滴定管读数上边大下边小;
C.洗气装置中导气管应该遵循“长进短出”原则;
D.在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,用饱和的碳酸钠溶液收集乙酸乙酯.
解答 解:A.除去粗盐溶液中的不溶物用过滤的方法,过滤时,漏斗底部应该紧靠烧杯内壁,玻璃棒下端应紧靠过滤器中三层滤纸一侧,故A错误;
B.滴定管大刻度在下方、小刻度在上方,该刻度是11.80mL,故B错误;
C.除去CO气体中的CO2气体,气流方向应为长管进气,短管出气,故C错误;
D.在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,乙醇易溶于水,乙酸和碳酸钠反应生成乙酸钠和二氧化碳、水,饱和碳酸钠溶液能降低乙酸乙酯溶解度,所以乙酸乙酯的制备演示实验如图所示,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、物质制备、仪器使用等知识点,明确实验原理及物质性质是解本题关键,注意D中饱和碳酸钠溶液作用,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
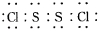 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的反应类型为加成反应 | |
| B. | X、Z均能与Na2CO3溶液反应 | |
| C. | X、Y、Z均能使溴水褪色,且原理相同 | |
| D. | X可作缩聚反应单体,Y可作加聚反应单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA | |
| C. | 常温常压下,4.6 g乙醇中含有的极性共价键数目为0.8NA | |
| D. | 在1 L 1.0 mol•L-1碳酸钠溶液中,阴离子总数大于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z | |
| B. | 氢化物的稳定性:X>Y | |
| C. | 原子失电子能力:W<Z | |
| D. | X与Y形成的简单化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:Na>K | B. | 稳定性:HCl>HBr | C. | 还原性:I?>Br? | D. | 碱性:KOH>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com