
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
 ,
, ;
;| 1 |
| 8 |
| 1 |
| 2 |
 晶胞中C60分子间的最短距离为d cm,则棱长为
晶胞中C60分子间的最短距离为d cm,则棱长为| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| n?M |
| V |
| ||
| V |
| N?M |
| V?NA |
| 4×720 | ||
2
|
720
| ||
| d3NA |
720
| ||
| d3NA |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
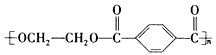 .现以煤的干馏产品A与F为原料制备PET,生产流程如图所示.其中A为烃,含碳元素的质量分数为90.6%,其蒸气的密度是空气密度的3.66倍,能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.M分子里所有原子共平面.
.现以煤的干馏产品A与F为原料制备PET,生产流程如图所示.其中A为烃,含碳元素的质量分数为90.6%,其蒸气的密度是空气密度的3.66倍,能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.M分子里所有原子共平面.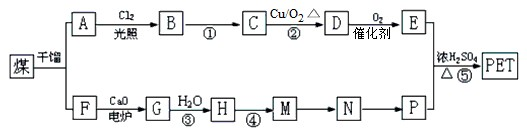
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用萃取的方法分离汽油和煤油 |
| B、用溶解、过滤的方法分离硝酸钾和氯化钠固体混合物 |
| C、将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
| D、加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com