
回答下列有关Na2S溶液的问题。
(1)Na2S溶液盛装在带橡胶塞的试剂瓶中,仔细闻有臭鸡蛋气味,请用离子方程式解释:
, 。
(2)将Na2S溶液加入AlCl3溶液中,有白色沉淀和臭鸡蛋气味的气体生成,发生的离子反应为:
。
(3)将Na2S溶液加入AgCl的浊液中,生成的黑色沉淀是 (写化学式)。
科目:高中化学 来源: 题型:填空题
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| NH3·H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH_____7(填“<”、“=”或“>”),其原因是_________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4) 下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(5) 25℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1 ______C2(填“<”、“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH 11(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。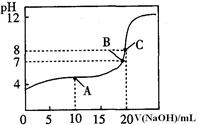
①为减小实验误差,由图可知滴定时指示剂应选用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是 点对应的溶液;
③25OC,HA的电离平衡常数约为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1) 25℃时,部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 | Ki=1.7×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh= mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为  (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com