
| A. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要大一些 | |
| B. | 用玻璃棒蘸取高锰酸钾溶液,滴在pH试纸上,然后与标准比色卡对照,测定其pH | |
| C. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| D. | 容量瓶、滴定管使用前均需检漏,并需要润洗以减小实验误差 |
分析 A.滴定未知浓度的氢氧化钠溶液时,反应终点在pH=7~8左右,选用酚酞作指示剂;
B.高锰酸钾具有强氧化性;
C.乙酸与氢氧化铜发生中和反应,葡萄糖可被氧化,淀粉不反应;
D.容量瓶不能润洗.
解答 解:A.滴定未知浓度的氢氧化钠溶液时,反应终点在pH=7~8左右,选用酚酞作指示剂,滴定终点与反应终点接近误差小,而选甲基橙作指示剂时与反应终点与滴定终点的差距大,则误差大,故A错误;
B.高锰酸钾具有强氧化性,可氧化试纸,不能用pH试纸测定,故B错误;
C.乙酸与氢氧化铜发生中和反应,葡萄糖可被氧化,淀粉不反应,可鉴别,故C正确;
D.容量瓶不能润洗,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、中和滴定以及溶液的配制等,把握反应原理及混合物分离提纯方法、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
)为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):



 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D四种短周期元素的核电荷数依次增大.A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds区,F原子核外有33种不同运动状态的电子.根据以上信息用相应的元素符号填空:
已知A、B、C、D四种短周期元素的核电荷数依次增大.A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds区,F原子核外有33种不同运动状态的电子.根据以上信息用相应的元素符号填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

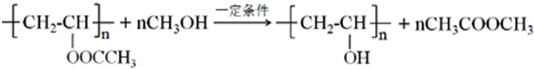
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 与乙醇发生酯化反应生成产物的分子式为C8H18O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物可以发生银镜反应 | |
| D. | 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、NO3-、CO32- | B. | Fe2+、OH-、SO42-、MnO4- | ||
| C. | Na+、Fe3+、Cl-、AlO2- | D. | K+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com