
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40gSiC晶体中含有2NA个Si-C共价键 | |
| B. | 标准状况下,22.4LCl2作为反应物参加反应时,转移的电子数一定为2NA | |
| C. | 1mol的CH≡CH中,所含σ键的总数为3NA | |
| D. | 常温常压下,100mL0.5mol/L的醋酸溶液中,醋酸根离子的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出.不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝.说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出.说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol.说明这三种金属的活泼性为:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯均能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇和乙醛均能发生氧化反应生成乙酸 | |
| C. | 油脂水解的产物是氨基酸和甘油 | |
| D. | 淀粉和聚乙烯都是天然髙分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(s) | B. | CH3COONa(s) | C. | FeCl3(s) | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 16g | B. | 8g | C. | 40g | D. | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、乙炔、溴苯分子中的所有原子均是共平面 | |
| B. | 乙烷(CH3CH3)和异丁烷( )互为同系物 )互为同系物 | |
| C. | 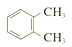 和 和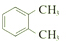 互为同分异构体 互为同分异构体 | |
| D. | 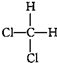 与 与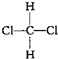 是同一种物质 是同一种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com