
| A. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| B. | 为防止寨卡病毒传播,可用漂粉精或双氧水对环境进行消毒 | |
| C. | 大力开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 硅酸钠溶液应存放在配有玻璃塞的广口试剂瓶中 |
分析 A.从赤潮、白色污染、绿色食品的涵义进行分析;
B.漂粉精或双氧水都具有强的氧化性,能够使蛋白质变性;
C.过分开发可燃冰,会影响海洋生态环境;
D.硅酸钠具有粘性,所以能将玻璃瓶塞和试剂瓶粘结在一起而打不开.
解答 解:A.赤潮是在特定的环境条件下,海水中某些浮游植物、原生动物或细菌爆发性增殖或高度聚集而引起水体变色的一种有害生态现象.赤潮是一个历史沿用名,它并不一定都是红色;白色污染是人们对难降解的塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓;绿色食品是指无污染、无公害的食品,以上均与颜色无关,故A错误;
B.病毒属于一种蛋白质,漂粉精或双氧水都具有强的氧化性,能够使蛋白质变性,可以用来杀菌消毒,故B正确;
C.过分开发可燃冰,会影响海洋生态环境,故C错误;
D.硅酸钠具有粘性,所以能将玻璃瓶塞和试剂瓶粘结在一起而打不开,所以硅酸钠溶液不能用磨口玻璃塞玻璃瓶存放,故D错误;
故选:B.
点评 本题为综合题,涉及环境污染与治理、蛋白质的性质、试剂的保存,明确常见环境污染,熟悉蛋白质变性方法,硅酸钠的性质是解题关键,题目难度不大,注意对相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 加冰醋酸 | B. | 加CH3COONa | C. | 加水 | D. | 加NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
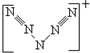 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).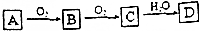
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Li、Na、K密度较小,应保存在煤油中 | |
| B. | CuO、Na2O、Mn2O7属于碱性氧化物 | |
| C. | SO2具有漂白性,可使溴水褪色 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4会产生沉淀而后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1molC20H42中含有的共价键数目为60nA | |
| B. | 1molCl2通过足量的NaOH溶液中充分反应转移的电子数为nA | |
| C. | a g 某气体含分子数为b,c g 该气体在标况下的体积为22.4bc/(a nA)升 | |
| D. | 2.24L(标况)辛烷在32 g 氧气中充分燃烧,生成CO2的分子数为0.8nA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
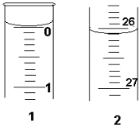 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com