
【题目】【山西省实验中学2017届下学期模拟热身】五种短周期元素A、B、C、D、E的性质及结构信息如下:
① 原子半径A>B>C>D>E;
② 五种元素之间形成的常见的四种分子如下:
甲 | 乙 | 丙 | 丁 | |
比例模型 |
|
|
|
|
组成元素 | D、E | B、E | A、D、E | C、E |
电子总数 | 10 | 18 | 26 | 10 |
请根据上述信息回答下列问题:
(1)A元素的单质与物质甲发生反应的离子方程式为_______,其化学反应平衡常数的表达式为___。
(2)戊与乙互为同系物,有五种同分异构体,戊的分子式为_____,己与乙具有相同的电子数,与甲含有的元素种类相同,己分子的结构式为_______。
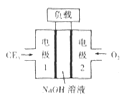
(3)C与E元素组成的CE3与液氮可组成燃料电池,产物均为无污染的物质,可用于驱动潜艇,燃料电池装置如下图所示。该电池的负极反应式为_____。电池工作时OH-向_____移动(填“正极”或“负极”)。
(4)B与D组成的一种物质在自然界中可循环,循环时其与CaCO3反应。已知Ksp(CaCO3)=2.8×10-9,现将CaCl2溶液与Na2CO3溶液等体积混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀的最小浓度为__________(忽略混合前后溶液的体积变化)。
【答案】Cl2+H2O=Cl-+H++HClO  C6H14 H-O-O-H 2NH3-6e-+6OH-=N2+6H2O 负极 5.6×10-5mol/L
C6H14 H-O-O-H 2NH3-6e-+6OH-=N2+6H2O 负极 5.6×10-5mol/L
【解析】根据五种元素之间形成的常见的四种分子的比例模型结合原子半径A>B>C>D>E,可知,甲为水分子,乙为乙烷分子,丙为HClO分子,丁为氨气分子,则A为Cl、B为C、C为N、D为O、E为H。
(1)氯气与水反应的离子方程式为Cl2+H2O=Cl-+H++HClO,其化学反应平衡常数的表达式K=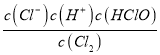 ;
;
(2)有五种同分异构体的烷烃的分子式为C6H14,己与乙烷具有相同的电子数,与水含有的元素种类相同,则己为过氧化氢,结构式为H-O-O-H;
(3)NH3与液氮可组成燃料电池,产物均为无污染的物质,水和氮气,氨气在负极发生氧化反应,电极反应式为2NH3-6e-+6OH-=N2+6H2O,根据电极反应式,电池工作时OH-向负极移动;
(4) Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=![]() mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L。
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L。


科目:高中化学 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】甲乙两实验小组同学对铁及其化合物的性质进行如下探究:
I.甲组同学利用如图装置探究过量铁粉与浓H2SO4反应产生的气体成分。
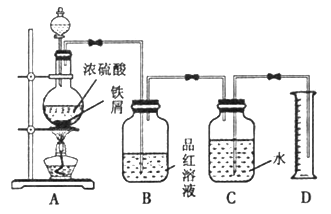
(1)组装好实验仪器后,接下来的实验操作是____________________;
(2)B中观察到品红溶液褪色,D中收集到VmL水,说明A中反应产生气体的成分
是______________________。
II.乙组同学对反应后圆底烧瓶溶液中所含金属离子进行探究。
(3)铁与浓H2SO4的反应过程中必有Fe3+生成。取适量反应后的溶液,加入少量KSCN溶液,不变红色。原因是_______________(用离子方程式表示)。
(4)取适量反应后的溶液,加人少量酸性高锰酸钾溶液,溶液褪色。该反应原理的离子方程式为 _______________________。
(5)取少量反应后的溶液,先滴加少量新制氯水,再滴加KSCN溶液,呈现血红色,继续滴加过量新制氯水,红色褪去。
①分析其可能的原因是:
A.溶液中Fe3+被氧化成更髙价;
B.____________________________;
C.______________________。
②请选用下列合适的化学试剂,验证结论A是否正确。0.lmol/L FeCl3溶液、lmol/L FeCl2溶液、KSCN溶液、新制氯水、一定浓度的H2O2溶液。
操作、现象及相关结论为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:
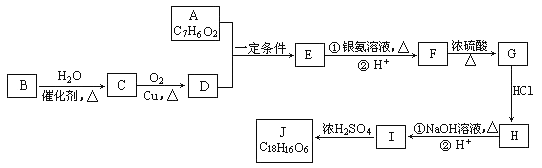
已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4种氢,且峰面积之比为1︰2︰2︰1。
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③![]()
回答以下问题:
(1)A中含有的官能团名称是_________________________________。
(2)写出有机反应类型B→C__________,F→G_________,I→J_________。
(3)写出F生成G的化学方程式____________________________________。
(4)写出J的结构简式__________________________________。
(5)E的同分异构体有多种,写出所有符合以下要求的E的同分异构体的结构简式_____________。
①FeCl3溶液发生显色反应 ②能发生银镜反应
③苯环上只有两个对位取代基 ④能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 分子中键能越大,键长越长,则分子越稳定
B. 失电子难的原子获得电子的能力一定强
C. 在化学反应中,某元素由化合态变为游离态,该元素被还原
D. 电子层结构相同的不同离子,其半径随核电荷数增多而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了提纯下列物质(括号内为杂质),除杂试剂和分离方法均正确的是
选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙醇(乙醇钠) | Na | 过滤 |
B | 溴苯(Br2) | 苯 | 萃取 |
C | 苯甲酸(NaCl) | 水 | 重结晶 |
D | 苯(苯酚) | NaOH溶液 | 蒸馏 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 标准状况下,22.4L水中所含的分子数约为6.02×1023
B. 标准状况下,aL的氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
C. 22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数不同
D. 2.24L CO2中含有的原子数为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数。下列说法中正确的是
A. 14gC8H16中的共用电子对数为3NA
B. 1mol苯中的碳碳双键数目为3NA
C. 1mol 二肽中含有的肽键数目为2NA
D. 30g甲酸甲酯与甲醛的混合物完全燃烧,生成的CO2的分子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的分类正确的是
A. 烧碱、纯碱均属于碱 B. 氨水、液氯均属于电解质
C. H2SO4、NH3均属于酸 D. SO2、CO2均属于酸性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com