
根据如图的转化关系判断下列说法正确的是(反应条件已略去)

A. 反应①②③④⑤均属于氧化反应和离子反应
B.反应⑤说明该条件下铝的还原性强于锰
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应①中氧化剂与还原剂的物质的量之比为1:4
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的数值,下列说法正确的是( ).
A.标准状况下,11.2L H2O所含的水分子数目为0.5NA
B.16g O2和O3的混合气体中所含的氧原子数目为NA
C.1.00mol/L Na2CO3溶液中所含Na+的数目为2NA
D.0.1mol Zn与含0.1mol HCl的盐酸充分反应,产生H2数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:填空题
金属材料在日常生产生活中有着广泛的应用,请回答下列问题:
(1)人类最早使用的合金是___________,目前使用量最大的金属是________。
(2)铁和铁合金是日常生活中的常用材料,下列叙述正确的是________。
A.纯铁的硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中会钝化
(3)向沸水中滴入几滴饱和FeCl3溶液,加热至液体呈透明的红褐色,该反应的离子方程式为__________,形成的分散系中分散质的微粒直径范围是_________。
(4)向硫酸亚铁溶液中加入过氧化钠,有红褐色沉淀生成,如果加入的Na2O2与生成的O2的物质的量之比为3:1,请写出发生的离子反应方程式___________________。
(5)电子工业需要用30%的FeCl3溶液腐蚀绝缘板上的铜,制造印刷电路板。请写出FeCl 3 溶液与铜反应的离子方程式:_________________,向腐蚀后的废液中加入一定量的铁粉充分反应后,无固体剩余,则反应后的溶液中一定含有的离子是___________,可能含有的离子是_________。如果从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水。需要用到的一组试剂是_______。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(6)高铁酸钠(Na2FeO4)是一种新型净水剂。高铁酸钠的制备方法之一是:在碱性条件下用NaClO氧化Fe3+,请写出该反应的离子反应方程式______________。
(7)有一种铁的氧化物样品,用5mol/L盐酸140mL,恰好完全溶解,所得溶液还能吸收标况下0.56L氯气,恰好使其中Fe2+全部转化成Fe3+,该氧化物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:选择题
在强酸性溶液中能大量共存,且溶液为无色透明的离子组是( )
A.Na+、A13+、SO42-、NO3- B.Ba2+、Na+、SO42-、NO3-
C.K+、Mg2+、MnO4-、SO42- D.K+、Na+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.用KSCN溶于检验Fe2(SO4)3溶液中是否含有FeSO4
B.由同种元素组成的物质一定是纯净物
C.将钢闸门与电源正极相连,可防止其在海水中被腐蚀
D.浊液、胶体、溶液三种分散系的本质区别是分散质微粒直径的大小不同
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
根据下表信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号 | G | L | M | Q | R | T |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
主要化合价 | +1 | +2 | +3 | +6、﹣2 | +5、﹣3 | ﹣2 |
A.单质的还原性:G<L<M B.非金属性:T<Q
C.气态氢化物的稳定性:R>T D.L2+与T2﹣的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次周练化学试卷(解析版) 题型:实验题
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β?锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
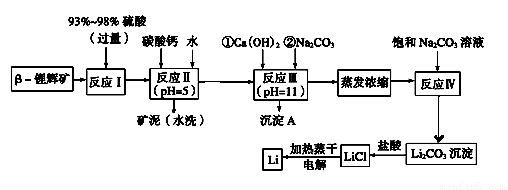
已知:
①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiA lSi2O6的组成:_______________________
lSi2O6的组成:_______________________
(2)反应Ⅱ加入碳酸钙的作用是____________________
(3)写出反应Ⅲ中生成沉淀A的离子方程式:____________________
(4)洗涤所得Li2CO3沉淀要使用“热水”还是“冷水”理由是____________________
(5)流程中两次使用了Na2CO3溶液,第一次浓度小,第二次浓度大的原因是____________________
(6)该工艺中,电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是____________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省淄博市高二上学期开学测化学试卷(解析版) 题型:选择题
下列选用的试剂能达到对应实验目的的是
| 实验目的 | 选用试剂 |
A | 检验FeCl2溶液是否变质 | KSCN溶液 |
B | 除去氨气中的水蒸气 | 浓H2SO4 |
C | 除去乙酸乙酯中的乙酸 | NaOH溶液 |
D | 除去二氧化碳中少量的氯化氢气体 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上9月月考化学试卷(解析版) 题型:选择题
现有下列两个图像:下列反应中符合两图像的是

A.N2(g)+3H2(g)≒2NH3(g) ΔH<0
B.2SO3(g)≒2SO2(g)+O2(g) ΔH>0
C.4NH3(g)+5O2(g)≒4NO(g)+6H2O(g) ΔH<0
D.H2(g)+CO(g)≒C(s)+H2O(g) ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com