
| A、向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量却并非是最大值 |
| B、将0.12mol Cl2通入到100mL 1mol/L的FeI2溶液中,离子方程式是:12Cl2+10Fe2++14I-→10Fe3++7I2+24Cl- |
| C、较高的温度下,可以测得0.1mol/L氨水的电离度为55%左右 |
| D、十六烷的裂化产物中不饱和烃的分子数可能会超过50% |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B、神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,是一种新型无机非金属材料 |
| C、在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 |
| D、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 与 与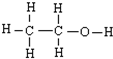 都可以用来描述乙醇的结构 都可以用来描述乙醇的结构 | ||||||||
B、最近合成117号元素的反应为:
| ||||||||
| C、中学阶段对氮原子核外电子运动状态描述最详尽的是:1s22s22p3 | ||||||||
D、 该有机物的系统名称为:2-甲基-1-丙醇 该有机物的系统名称为:2-甲基-1-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
C、已知 +SO2+H2O→ +SO2+H2O→ +Na2SO3,说明给出质子能力:HSO3->苯酚 +Na2SO3,说明给出质子能力:HSO3->苯酚 | ||||
D、已知CaCO3+SiO2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打溶液显碱性:HCO3-+H2O═H2CO3+OH- |
| B、FeCl3溶液中滴加过量的氨水:Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+ |
| C、CuSO4溶液中滴加过量的氨水:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O |
| D、向FeSO4溶液中加少量过氧化钠粉末:6H2O+4Na2O2+4Fe2+═4Fe(OH)3↓+O2↑+8Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,Na2O2在这个反应中只做氧化剂 |
| B、C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l);△H=-1367.0kJ/mol(燃烧热) |
| C、过量的NaHCO3溶液与Ca(OH)2溶液反应的离子方程式是:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某种燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
已知某种燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com