
(14分)以下是一些物质的熔沸点数据(常压):
| 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:
4Na(g)+3CO2(g) 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式: 。
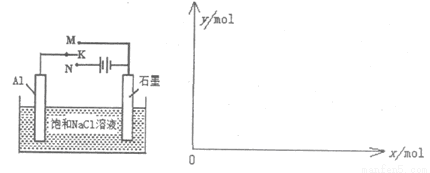
(5)下图开关K接M时,石墨作 极,电极反应式为 。当K接N一段时间后,测得有0.3mol电子转移,作出y随x变化的图象【x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据】
(1) K=1/c4(Na) c3(CO2)(2分);否(1分) (2)0.0015 mol/(L ·min)(2分)
(3)增大压强加快反应速率,反应向正反应方向移动 (2分)
(4)6Na2O(s)+ 2C(s,金刚石)=8Na(g)+ 2Na2CO3(l)△H= —8.4 kJ/mol (2分)
(5)正(1分); O2+2H2O+4e-=4OH-(2分)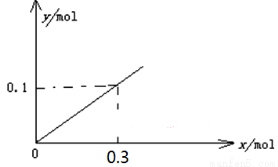 (2分)
(2分)
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,固体或纯液体不能出现在平衡常数表达式中,则该反应的平衡常数表达式为K=1/c4(Na) c3(CO2);若反应达到平衡状态,则根据反应速率之比是相应的化学计量数之比可知,3v正(Na)=4v逆(CO2),因此4v正(Na)=3v逆(CO2)时反应没有达到平衡状态。
(2)反应时间为10min,金属钠的物质的量减少了0.2mol,则根据方程式可知消耗CO2的物质的量是0.15mol,浓度是0.015mol/L,因此10min里CO2的平均反应速率为0.015mol/L÷10min=0.0015 mol/(L ·min)。
(3)根据方程式可知,正方应是体积增大的可逆反应,因此增大压强加快反应速率,反应向正反应方向移动,有利于金刚石的制备。
(4)根据反应①4Na(g)+3CO2(g) 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol,②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol,则根据盖斯定律可知①-②×3即得到6Na2O(s)+ 2C(s,金刚石)=8Na(g)+ 2Na2CO3(l)△H= —8.4 kJ/mol。
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol,②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol,则根据盖斯定律可知①-②×3即得到6Na2O(s)+ 2C(s,金刚石)=8Na(g)+ 2Na2CO3(l)△H= —8.4 kJ/mol。
(5)开关K接M时,构成原电池,铝是活泼的金属作负极,则石墨作正极,溶液性质中性,所以吸氧腐蚀,则正极电极反应式为O2+2H2O+4e-=4OH-。当K接N时构成电解池,铝是阳极失去电子,石墨是阴极溶液中的氢离子放电生成氢气,总反应式为2Al+6H2O 2Al(OH)3+3H2↑,因此一段时间后,测得有0.3mol电子转移,则消耗水的物质的量是0.3mol,生成氢氧化铝是0.1mol,因此y随x变化的图象为(见答案)。
2Al(OH)3+3H2↑,因此一段时间后,测得有0.3mol电子转移,则消耗水的物质的量是0.3mol,生成氢氧化铝是0.1mol,因此y随x变化的图象为(见答案)。
考点:考查平衡常数、反应速率、外界条件对平衡状态影响、热化学方程式阴极电化学原理应用


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
下表为各物质中所含少量杂质以及除去这些杂质所选用的试剂或操作方法,正确的是
序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
② | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
③ | CH4 | C2H4 | 通过盛有酸性高锰酸钾溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发结晶 |
A.④ B.③④ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:填空题
(6分)将某种烃进行氯代反应,测出一氯代物只有1种。7.2 g该烃完全生成一氯代物时,放出的气体用蒸馏水完全吸收,所得溶液用0.2 mol·L-1NaOH溶液500 mL恰好中和。则此烷烃的分子式为 ,其结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使KMnO4(H+)溶液褪色;②苯分子中碳原子的距离均相等;③苯能在一定条件下跟H2加成生成环己烷;④经实验测得邻二甲苯仅一种结构;⑤苯在FeBr3存在条件下同液溴发生取代反应,但不因化学变化而使溴水褪色。
A.②③④⑤B.①③④⑤C.①②④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列各组中的分子,全部是以极性键形成非极性分子的是
A.H2、N2、Cl2 B.CH4、NH3、H2O
C.HCl、NO、Br2 D.CO2、CS2、CCl4
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市红桥区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
已知NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4 L O2和O3组成的混合物中原子总数为2NA
B.1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA
C.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
D.1 mol重甲基(-CD3)含有电子数为9NA
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:填空题
(18分)化合物A是一种重要的有机化工原料,A的有关转化反应如下(部分反应条件略去)。已知:F和E互为同分异构体:R表示烃基,R和R 表示烃基或氢
表示烃基或氢
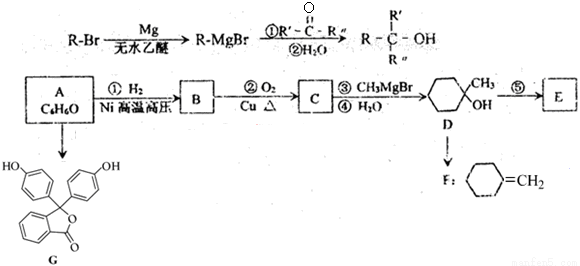
(1)G是常用的指示剂酚酞,G的含氧官能团名称: ,G的分子式为 。
(2)反应②的反应类型: ;A与甲醛在酸催化条件下可生成一种绝缘树脂材料,此反应类型为 。
(3)写出下列反应的化学方程式:
A与饱和溴水的反应: ;
反应⑤(写明反应条件) 。
(4)化合物H是D的同分异构体,其核磁共振氢谱表明只有两种吸收峰。符合上述条件的H的结构有多种,写出其中一种化合物的结构简式: 。
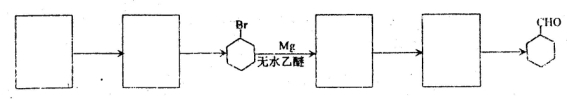
(5)结合已知信息,请补充以A和HCHO为原料制备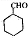 的合成路线流程图(无机试剂任选),方框内写有机物结构简式,在“→”上或下方写反应所需条件或试剂。
的合成路线流程图(无机试剂任选),方框内写有机物结构简式,在“→”上或下方写反应所需条件或试剂。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三总复习质量检测一理综化学试卷(解析版) 题型:选择题
氡是放射性稀有气体元素,氡气吸入体内有害健康,氡的核电荷数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”,是由质子数86,质量数219的原子组成,下列有关氡的说法正确的是
A.氡气在标准状况下密度约是19.82g
B.氡气化学性质较活泼,因此对人体有害
C.氡原子核外有7个电子层,最外层有8个电子
D.“锕射气”是氡的同位素
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:填空题
(1)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示,
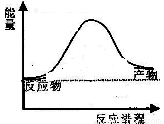
则该反应为 反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
则该反应吸收或放出热量为 kJ(用含a b c d字母的代数式表示)
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生
CH4(g)+ 2H2O(g)  CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则 ① 前4s以H2O(g)浓度变化表示的平均反应速率为多少?② 4s时,混合气体中H2的体积分数为多少?③ 平衡时,CH4的浓度是多少?
(要求:写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com