
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,16g O2含有的原子数为1 NA | |
| C. | 通常状况下,1 NA 个SO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的K2CO3溶液中,含有CO32-个数为0.5 NA |
分析 A、标况下水为液态;
B、氧气由氧原子构成;
C、通常状态下,气体摩尔体积大于22.4L/mol;
D、溶液体积不明确.
解答 解:A、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故A错误;
B、氧气由氧原子构成,故16g氧气中含有的氧原子的物质的量为1mol,即为NA个,故B正确;
C、通常状态下,气体摩尔体积大于22.4L/mol,故NA个二氧化硫分子即1mol二氧化硫所占据的体积大于22.4L,故C错误;
D、溶液体积不明确,故溶液中的碳酸根的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
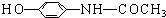 下列关于该物质的描述,不正确的是( )
下列关于该物质的描述,不正确的是( )| A. | 该化合物分子式为C8H9O2N | |
| B. | 能和银氨溶液发生银镜反应 | |
| C. | 能和氢氧化钠发生反应 | |
| D. | 其分子中的原子不可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .一定条件下,硫与地壳中含量最多的非金属元素X可组成两种常见的化合物,则X是O,两种化合物均含有的化学键为共价键
.一定条件下,硫与地壳中含量最多的非金属元素X可组成两种常见的化合物,则X是O,两种化合物均含有的化学键为共价键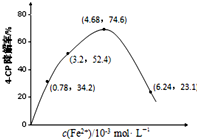
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧:发出白光,生成大量的白色烟雾 | |
| B. | 碳酸钠溶液与氢氧化钙溶液反应:溶液中产生气泡 | |
| C. | 氢气在空气中燃烧:无色气体燃烧,发出淡蓝色火焰,放热 | |
| D. | 镁条在空气中燃烧:银白色固体燃烧,生成白色固体氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑦ | C. | ①②⑥ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com