
【题目】已知HA为一元酸,常温下向20mL0.01mol/L的HA溶液中滴加0.01mol/L的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图所示。下列说法不正确的是
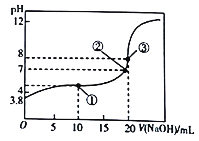
A. 常温下,该酸的电离常数K=10-5.6
B. 该测定过程中不可以选择甲基橙为指示剂
C. 滴定至①处时,溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-)
D. 由①到③过程中,水的电离程度先增大后减小
【答案】D
【解析】根据0.01mol/L的HA溶液pH大于2可以知道HR为弱酸,该过程为一元强碱滴定一元弱酸的过程,①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;②点溶液中呈中性;③点溶液是二者恰好完全反应生成NaA,强碱弱酸盐,溶液显碱性;酸碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用,以此分析解答。
详解:A. HA![]() H++A-,pH=3.8,c(H+)=10-3.8,该酸的电离常数K=
H++A-,pH=3.8,c(H+)=10-3.8,该酸的电离常数K=![]() =
=![]() =10-5.6,故A正确;
=10-5.6,故A正确;
B.该测定为强碱滴弱酸,反应完全时,生成强碱弱酸盐,溶液显碱性,应该选择酚酞为指示剂,若选用甲基橙为指示剂,因甲基橙变色范围3.1![]() 4.4,误差较大,故B正确;
4.4,误差较大,故B正确;
C. ①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;HA的电离大于A-水解,则溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-),故C正确;
D. 在①、②、③点对应的溶液中, ①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;②点溶液中呈中性;③点溶液是二者恰好完全反应生成NaA,强碱弱酸盐,溶液显碱性;酸碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用,所以由①到③过程中,水的电离程度逐渐增大,故D错误;
综上所述,本题正确答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】2018年5月9日科技网报道,最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇。
(1)甲醇燃烧时发生如下反应(a、b、c、d均大于0):
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H1=-akJ·mol-1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) △H2=-bkJ·mol-1
③CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) △H3=-ckJ·mol-1
④CH3OH(1)+O22(g)=CO (g)+2H2O(1) △H4=-dkJ·mol-1
由此知,a、b、c、d由小到大排序为_______。
(2)工业上,通常采用氢气还原CO2法制备甲醇CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(1) △H
CH3OH(g)+H2O(1) △H
已知几种化学键的键能数据如下:
共价键 | C=O | H-H | C-O | C-H | H-O |
键能/kJ·mol-1 | 803 | 436 | 326 | 414 | 464 |
根据键能数据估算上述反应中△H=____________kJ·mol-1。
(3)在2L恒容密闭容器中充入2 mol CO2和6.5mlH2,在一定温度下反应,测得混合气体中c(CH3OH)与时间的关系如图1所示。

①M点CO2的正反应速率___________N点CO2的逆反应速率(选填“大于”“小于”或“等于”)。
②0~10min内H2的平均反应速率v(H2)=___________mol·L-1·min-1。
③在该温度下,该反应平衡常数K为________。(结果保留两位小数并要求带单位)
(4)在密闭容器中充入一定量CO2和H2,在含铂催化剂作用下反应,测得单位时间内CO2的转化率与温度关系如图2所示。
①R点对应的CO2转化率最大,其原因是_________________。
②在Q点时CO2的转化率突变的原因可能是_________________。
(5)以石墨为电极,甲醇/空气碱性(KOH溶液为电解质溶液)燃料电池的能量转化效率高。当KOH恰好完全转化成KHCO3时停止放电,此时负极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是 ________(用字母代号填)。
A.Fe B.FeCl3C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 ________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是_________________________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③______________④________________
B请写出通入⑥的化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。

下列说法中正确的是
A. 一分子雷琐苯乙酮含有3个碳碳双键
B. 苹果酸的一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子可大量共存且溶液无色的是( )
A. Cu2+、SO42-、Fe3+、Cl- B. Na+、NO3-、K+、SO42-
C. MnO4-、Al3+、Na+、SO42- D. Fe2+、H+、ClO-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 聚乙炔用I2或Na等做掺杂后可形成导电塑料,该导电塑料具有固定的熔点、沸点
B. 天然橡胶、植物油和裂化汽油都是混合物,其中只有植物油能使溴水因反应褪色
C. 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH ![]()
![]() ,其过程符合绿色化学的原则
,其过程符合绿色化学的原则
D. 合成橡胶![]() 的单体之一是CH3-C≡C—CH3
的单体之一是CH3-C≡C—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2+ O2![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com