
| A. | O2 | B. | H2O | C. | K2SO4 | D. | CH4 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键.
解答 解:A.氧气分子中O-O原子之间只存在共价键,属于单质,故A错误;
B.水分子中O-H原子之间只存在共价键,属于共价化合物,故B错误;
C.硫酸钾中钾离子和硫酸根离子之间存在离子键、硫酸根离子中S-O原子之间存在共价键,属于离子化合物,故C正确;
D.甲烷分子中C-H原子之间存在共价键,属于共价化合物,故D错误;
故选C.
点评 本题考查离子化合物和共价化合物的判断,侧重考查基本概念,明确化合物和化学键的关系是解本题关键,明确常见物质的构成微粒,题目难度不大.


科目:高中化学 来源: 题型:选择题
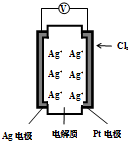 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 电子由Ag电极经外电路流向Pt电极 | |
| B. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| C. | 正极反应:Cl2+2e-+2Ag+═2AgCl | |
| D. | 原电池工作时电解质中Ag+数目减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KF的电子式: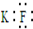 | |
| B. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| C. | 硫离子的结构示意图: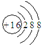 | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaCl、NaBr、NaI混合溶液中通入F2:I-、Br-、Cl- | |
| B. | 向NaCl、NaI、Na2S混合溶液中滴加AgNO3溶液:S2-、I-、Cl- | |
| C. | 向FeCl3、CuCl2、HCl混合溶液中加入Zn粉:Cu2+、Fe3+、H+ | |
| D. | 向NaAlO2、Na2CO2、NaOH混合溶液中滴加稀盐酸:AlO2-、CO32-、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4(熔融)═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
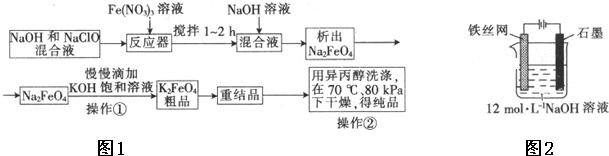
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④⑤⑥ | C. | ④⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com