
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收1mol SO2就会放出5.6LCO2 |
分析 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,以此来解答.
解答 解:A.由2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中S元素的化合价变化可知,硫元素既被氧化又被还原,故A正确;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.反应中2Na2S转化为3Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移$\frac{8}{3}$mol电子,故C错误;
D.根据方程式可知,每吸收4mol SO2就会放出1molCO2,则每吸收1mol SO2就会放出0.25molCO2,Vm未知不能计算其体积,故D错误;
故选A.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意从元素的化合价角度分析,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ?达到化学平衡时?4v正(O2)=5v逆(NO) | |
| B. | ?若单位时间内生成x mol NO的同时消耗x mol NH3?则反应达到平衡状态 | |
| C. | ?达到化学平衡时若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | ?当混合气体的压强不随时间变化时,此反应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某溶液中滴加AgNO3溶液,若产生白色沉淀,说明该溶液中有Cl- | |
| B. | 在某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl- | |
| C. | 在某溶液中先滴加AgNO3溶液,产生色沉淀,再滴加盐酸,沉淀不消失,说明溶液中Cl- | |
| D. | 某溶中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明溶液中有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
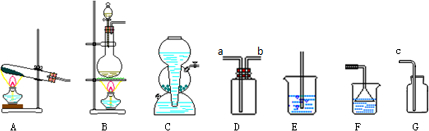
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂能加快反应速率 | |
| B. | 增大压强能减慢反应速率 | |
| C. | 达到平衡时,反应速率:v(正)=v(逆)=0 | |
| D. | 达到平衡时,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
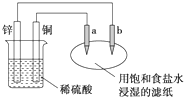
| A. | a为阳极,发生氧化反应:锌为负极被还原 | |
| B. | 电路中电子流动方向:锌→b→a→铜 | |
| C. | 电路中通过0.2mol电子,铜片上产生2.24L气体 | |
| D. | 往滤纸上滴加酚酞,b极附近颜色变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
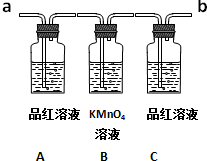 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
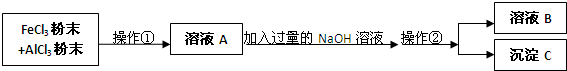
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com