
【题目】利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)
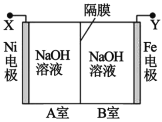
A.Y 是外接电源的正极,Fe 电极上发生还原反应
B.Ni 电极上发生的电极反应为:2H2O - 4e-== O2↑+4H+
C.若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室
D.电解后,撤去隔膜,充分混合,电解液的 pH 比原来小
科目:高中化学 来源: 题型:
【题目】取相同质量的H2O和D2O分别与少量金属钾反应完全,若电子转移数目相同,则下列叙述中有关物理量不相等的是( )
A.反应消耗H2O和D2O的物质的量B.产生气体在相同条件下的体积
C.反应后所得溶液溶质的质量分数D.参加反应金属钾的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。乙醚浸取法的主要工艺如图所示:
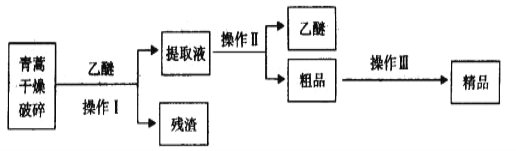
已知:青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。乙醚沸点为35℃。下列叙述错误的是( )
A.对青蒿干燥破碎后,加入乙醚的目的是溶解青蒿素
B.操作Ⅰ需要的玻璃仪器主要有烧杯、漏斗、玻璃棒
C.操作Ⅱ的名称是过滤
D.操作Ⅲ的主要过程可能是加95%的乙醇,浓缩、结晶、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是化工生产重要原料甲叉琥珀酸的合成路线:

已知:R-Br+NaCN→R-CN+NaBr,R-CN![]() R-COONa+NH3↑,R-CCl3
R-COONa+NH3↑,R-CCl3![]() R-COONa+NaCl。
R-COONa+NaCl。
(1)已知A核磁共振氢谱中有两组吸收峰,且A不存在顺反异构,则A的名称为____。
(2)E的官能团名称为_____,B→C的反应类型是_____。
(3)写出下列过程的化学反应方程式:E→F:_____。
(4)写出符合下列条件的甲叉琥珀酸的同分异构体M的结构简式___。
①M可以使酸性高锰酸钾褪色
②1molM和足量的NaHCO3溶液反应,最多放出2molCO2
③核磁共振氢谱中只有三组吸收峰
(5)应用已学知识,以![]() 为原料设计合成
为原料设计合成![]() 的路线图(无机试剂任选)。____
的路线图(无机试剂任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案:测定某含有NaCl的小苏打样品中![]() 的质量分数。已知:
的质量分数。已知:![]() 受热分解成碳酸钠、二氧化碳和水。
受热分解成碳酸钠、二氧化碳和水。
(方案一)称取一定质量样品,置于仪器A中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)仪器A的名称为___________;A应该放在_________中冷却。恒重操作的目的是________。
(2)本实验从称量空的A仪器开始,完成一次平行实验至少需要称重____次。做平行实验的目的是___________。
(方案二)称取一定质量的样品(样品的质量为m0),置于小烧杯中,加适量水溶解;向小烧杯中加入足量澄清石灰水,过滤,洗涤、干燥,称量沉淀的质量为m1,计算。(已知碳酸钙式量为100,![]() 的式量为84)。
的式量为84)。
(3)反应方程式为_____________,则样品中![]() 的质量分数可以表示为_________。
的质量分数可以表示为_________。
(方案三)往Y形管中注入一定体积和浓度的稀硫酸并放入准确称取的ag样品,连接好注射器(如图),再将Y形管倾斜,使样品与酸液充分反应。
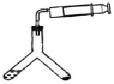
(4)a不能太大,理由是___________,若测定结果偏高,其原因可能是______(选填序号)。
①样品未完全反应
②温度未恒定即记录数据
③少量![]() 溶解在溶液中
溶解在溶液中
(方案四)称取一定质量样品,配成待测溶液,用标准盐酸滴定。
(5)下列叙述正确的是_______(选填序号)。
①用烧杯配制100mL待测溶液
②用酚酞为指示剂
③当滴至待测液变色并能将该颜色保持半分钟即为滴定终点
④盛盐酸的滴定管未润洗会造成实验结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,某金属有机多孔材料(MOFA)对CO2具有超高的吸附能力,并能催化CO2与环氧丙烷的反应,其工作原理如图所示。下列说法错误的是
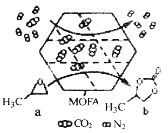
A.物质a分子中碳原子和氧原子均采取sp3杂化
B.b的一氯代物有3种
C.a生成b的反应类型为取代反应,并有极性共价键形成
D.该材料的吸附作用具有选择性,利用此法可减少CO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态硼原子的价电子轨道表达式是_______________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________。
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的________。
(3)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______,写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH![]() 的键角是________,立体构型为___________。
的键角是________,立体构型为___________。
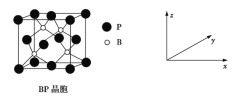
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______;已知晶胞边长为458 pm,则磷化硼晶体的密度是____g·cm-3(列式并计算,结果保留两位有效数字,已知4.583=96.07)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com