
 常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HA和HB溶液,得到2条滴定曲线,如下图所示(图1表示HA,图2表示HB),下列说洼正确的是( )
常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HA和HB溶液,得到2条滴定曲线,如下图所示(图1表示HA,图2表示HB),下列说洼正确的是( )| A、HA是弱酸,HB是强酸 |
| B、达到E点时,对应混合溶液中c(Na+)=c(B-)+c(HB) |
| C、达到B、D点时,两溶液pH均为7,反应消耗的n(HA)=n(HB) |
| D、当达到E点后,继续滴加NaOH溶液,对应混合溶液中各离子浓度由大到小的顺序均为c(Na+)>c(B-)>c(OH-)>c(H+) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

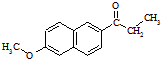 )外,最可能生成的副产物(与G互为同分异构体)的结构简式为
)外,最可能生成的副产物(与G互为同分异构体)的结构简式为 )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:| SOCl2 |
 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| HBr |
| NaOH |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、氧化剂与还原剂必须直接接触,才能发生反应 |
| B、乙池中电极反应式为NO3-+4H++e-═NO2↑+2H2O |
| C、当铜棒质量减少6.4g时,甲池溶液质量增加6.4g |
| D、当铜棒质量减少6.4g时,向乙池密封管中通入标准状况下1.12L O2,将使气体全部溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热可增强纯碱溶液去污力:CO32-+2H2O═H2CO3+2OH- |
| B、用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3-═Ag++NO↑++2H2O |
| C、向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2═2CO2+2CaSO4 |
| D、碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验内容 | 实验目的 |
| A. | 向盛有10滴0.1mol/L AgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol/L Na2S溶液 | 证明AgCl沉淀能转化为溶解度更小的Ag2S沉淀 |
| B. | 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL苯中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C. | 向Na2SiO3溶液中通入CO2 | 证明碳酸的酸性比硅酸强 |
| D. | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热 | 验证淀粉已水解 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用烧碱溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
| B、用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32-(aq)═CaCO3(s)+SO42-(aq) |
| C、实验室制备Fe(OH)3胶体:Fe3++3OH-═Fe(OH)3↓ |
| D、金属Na与水反应:Na+2H+═H2↑+Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol?L-1 NaClO溶液和0.1mol?L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥ | B、②③⑤⑦ |
| C、①③④⑤ | D、①②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com