
 U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH
U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH+ 4 |
 ,铝离子在水中发生水解生成氢氧化铝胶体,离子反应方程式为:Al3++3H2O?Al(OH)3+3H+,
,铝离子在水中发生水解生成氢氧化铝胶体,离子反应方程式为:Al3++3H2O?Al(OH)3+3H+, ;Al3++3H2O?Al(OH)3+3H+;
;Al3++3H2O?Al(OH)3+3H+; ,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,故答案为:
,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,故答案为: ;Na3N+3H2O=3NaOH+NH3↑;
;Na3N+3H2O=3NaOH+NH3↑;
| ||
| ||


科目:高中化学 来源: 题型:
 卤代烃里的卤原子易与活泼金属阳离子结合,发生下列反应:
卤代烃里的卤原子易与活泼金属阳离子结合,发生下列反应:| 乙醇 |
| 乙醇溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在碳酸氢钠溶液中加入过量的氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B、向明矾溶液中加入少量的Ba(OH)2溶液:Al3++3OH-+Ba2++SO42-=BaSO4↓+Al(OH)3↓ |
| C、向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ |
| D、向含有1molFeBr2溶液中通入标准状况下22.4L的Cl2:2Br-+Cl2=Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子量外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄钾铁矾中铁元素显+3价 |
| B、黄钾铁矾属于碱 |
| C、黄钾铁矾溶于硫酸后,滴加KSCN溶液,溶液变红 |
| D、黄钾铁矾晶体在酒精灯火焰上灼烧,透过蓝色的钴玻璃可观察到紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
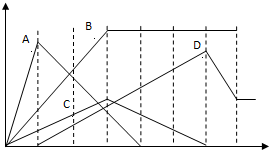 如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表.
如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表. | 序号 | 实验操作 | 对应编号 |
| ① | 向澄清石灰水中通入CO2至过量 | |
| ② | 向AlCl3溶液中逐滴加入氨水至过量 | |
| ③ | 向含有盐酸的MgCl2、AlCl3溶液中通入NaOH溶液至过量 | |
| ④ | 向NaAlO2溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF、HCl、HBr、HI的热稳定依次减弱 |
| B、金刚石的硬度大于硅,其熔、沸点也高于硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次减小 |
| D、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com