
分析 (1)常温下,纯水中c(H+)=10-7mol•L-1,加入某物质后,溶液中c(H+)=10-9mol•L-1,说明溶液呈碱性,则加入的物质的水溶液呈碱性;
(2)氯水中存在的平衡是Cl2+H2O?H++Cl-+HClO、HClO?H++ClO-,要使c(HClO)增大,加入某些物质使Cl2+H2O?H++Cl-+HClO的平衡向正反应方向移动或使HClO?H++ClO-的平衡向逆反应方向移动;
(3)一水合氨为弱电解质,不能完全电离,pH相同时,氨水浓度最大;
(4)①根据反应H2B(少量)+2A-=B2-+2HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强;
②铜离子和硫化氢只所以能生成硫化铜沉淀,硫化铜既难溶于水又难溶于酸;
(5)H2A=H++HA-,HA-?H++A2-可知,第一步完全电离,第二步不完全电离,结合0.1mol•L-1NaHA溶液的pH=2确定0.1mol•L-1的H2A溶液中氢离子浓度的大小范围,0.1mol•L-1NaHA溶液的pH=2,则HA-的电离大于其水解,再结合水解、电离的相关知识来解答;
解答 解:(1)常温下,纯水中c(H+)=10-7mol•L-1,加入某物质后,溶液中c(H+)=10-9mol•L-1,说明溶液呈碱性,则加入的物质是碱或强碱弱酸盐,故选CD,
故答案为:CD;
(2)氯水中存在的平衡是Cl2+H2O?H++Cl-+HClO、HClO?H++ClO-,要使c(HClO)增大,加入某些物质使Cl2+H2O?H++Cl-+HClO的平衡向正反应方向移动或使HClO?H++ClO-的平衡向逆反应方向移动,所以可以通入氯气或加入碳酸盐或加入次氯酸盐,
故答案为:再通入氯气、加入碳酸盐、加入次氯酸钠;
(3)一水合氨为弱电解质,不能完全电离,与盐酸反应至中性时,氨水应稍过量,则b>a,c(OH-)=1.0×10-3mol•L-1的氨水,一水合氨浓度远大于1.0×10-3mol.L-l的氨水,反应至中性时,a>c,氢氧化钡为强碱,与盐酸完全中和时,a=d,则b>a=d>c,
故答案为:b>a=d>c;
(4)①据反应H2B(少量)+2A-=B2-+2HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强,没有HB-生成,说明得电子能力A-大于HB-,则得电子能力顺序为A->B2->HB-,
故答案为:A->B2->HB-;
②铜离子和硫化氢只所以能生成硫化铜沉淀,硫化铜既难溶于水又难溶于酸,所以硫化氢和硫酸铜能反应;
故答案为:铜离子和硫化氢只所以能生成硫化铜沉淀,是因为硫化铜既难溶于水又难溶于酸;
(5)H2A=H++HA-,HA-?H++A2-可知,第一步完全电离,第二步不完全电离,0.1mol•L-1的H2A溶液中H2A第一步电离出氢离子浓度是0.1mol/L,0.1mol•L-1的NaH A溶液其pH=2,说明HA-电离比水解多出0.01mol/L,HA-的电离较微弱,所以电离出氢离子浓度小于0.01mol/L,则0.1mol•L-1的H2A溶液中氢离子浓度的大小范围是0.1mol/L<c(H+)<0.11mol/L,NaHA溶液中HA-的电离大于其水解,则离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案为:0.1mol/L<c(H+)<0.11mol/L,c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
点评 本题考查较为综合,题目难度较大,注意(4)①中比较阴离子结合H+的难易的顺序,酸的酸性越弱,其阴离子越溶液结合氢离子,为易错点.


科目:高中化学 来源: 题型:选择题
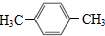 ,下列关于PX的说法正确的是( )
,下列关于PX的说法正确的是( )| A. | 属于饱和烃 | B. | 其一氯代物有四种 | ||
| C. | 可用于生产对苯二甲酸 | D. | 分子中所有原子都处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Fe(SO4)2•12H2O | B. | NH4Al(SO4)2•12H2O | C. | (NH4)2Fe(SO4)2•6H2O | D. | (NH4)2Fe(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5% | B. | 25% | C. | 50% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
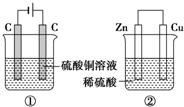 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 6种 | C. | 9种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
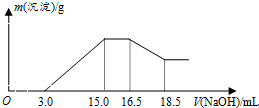
| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com