
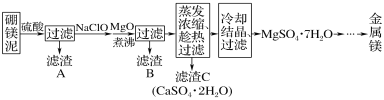
【题目】硼单质在高温时是良好的导体,也是用途广泛的化工原料。镁单质可用于制造轻金属合金、球墨铸铁等。硼镁矿的主要成分为Mg2B2O5·H2O,可以制取单质硼和镁。制取工艺流程如图所示,已知硼砂的化学式为Na2B4O7·10H2O,硼镁泥是硼镁矿制硼砂过程中产生的废渣,其主要成分是MgCO3,还含有CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。按要求回答问题:
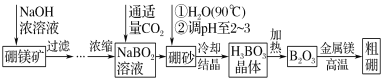
(1)化合物Mg2B2O5·H2O中B的化合价为_____。
(2)将硼砂溶于热水后,常用稀硫酸调pH至2~3制取H3BO3,该反应的离子方程式为____。
(3)写出加NaClO的过程中发生反应的离子方程式:________;________。
(4)将硼镁泥中加入的硫酸改为盐酸是否可行?___。(填“是”或“否”),理由是____。
【答案】+3 B4O72-+2H++5H2O=4H3BO3 Mn2++ClO-+H2O=MnO2↓+Cl-+2H+ 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O 否 改为盐酸后,硼镁泥中的CaO转化为CaCl2,CaCl2易溶于水,无法除去杂质钙离子
【解析】
(1)Mg2B2O5·H2O中Mg元素的化合价为+2价,H元素的化合价为+1价,O元素的化合价为-2价,根据化合物中各元素化合价代数和为零可得到Mg2B2O5·H2O中硼元素的化合价为+3,故答案为:+3。
(2)硼砂在酸溶液中生成一元弱酸H3BO3的离子方程式为B4O72-+2H++5H2O=4H3BO3,故答案为:B4O72-+2H++5H2O=4H3BO3。
(3)由题图2及硼镁泥的成分可,往硼镁泥中加硫酸得到的滤渣A的主要成分为SiO2,向滤液中加次氯酸钠可以将滤液中的Fe2+和Mn2+氧化,所以加入NaClO的过程中发生反应的离子方程式为:Mn2++ClO-+H2O=MnO2↓+Cl-+2H+、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,故答案为:Mn2++ClO-+H2O=MnO2↓+Cl-+2H+、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O。
(4)CaSO4微溶于水,CaCl2易溶于水,改为盐酸后,硼镁泥中的CaO转化为CaCl2,CaCl2易溶于水,无法除去杂质钙离子,故答案为:否;改为盐酸后,硼镁泥中的CaO转化为CaCl2,CaCl2易溶于水,无法除去杂质钙离子。


科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)晶体呈白色,见光分解,露置于潮湿空气中易被氧化。某研究小组设计如下两种方案在实验室制备氯化亚铜。
方案一:铜粉还原CuSO4溶液
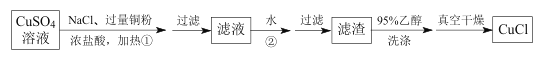
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3] 2-(无色溶液)。
[CuCl3] 2-(无色溶液)。
(1)步骤①中发生反应的离子方程式为________________。
(2)步骤②中,加入大量水的作用是_____________ 。
(3)如图流程中用95%乙醇洗涤和真空干燥是为了防止________________ 。
方案二:在氯化氢气流中加热CuCl22H2O晶体制备,其流程和实验装置(夹持仪器略)如下:
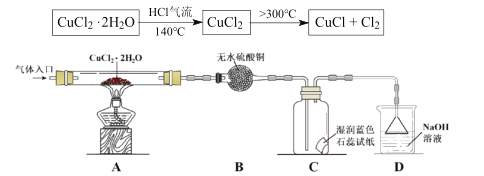
请回答下列问题:
(4)实验操作的先后顺序是 a→_____→______→_______→e (填操作的编号)
a.检査装置的气密性后加入药品 b.点燃酒精灯,加热
c.在“气体入口”处通入干燥HCl d.熄灭酒精灯,冷却
e.停止通入HCl,然后通入N2
(5)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是______。
(6)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因 ________________________。
(7)准确称取0. 2500 g氯化亚铜样品置于一定量的0.5 mol/L FeCl3溶液中,待样品完全溶解后,加水20 mL,用0. 1000 mol/L的Ce(SO4)2溶液滴定到终点,消耗24. 60 mLCe(SO4)2溶液。有关化学反应为Fe3++CuCl=Fe2++Cu2++Cl-、Ce4++Fe2+=Fe3++Ce3+,计算上述样品中CuCl的质量分数是_____________ %(答案保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠俗称大苏打、海波,主要用作照相业定影剂,还广泛应用于鞣革、媒染、化工、医药等行业。常温下,溶液中析出晶体为Na2S2O35H2O.Na2S2O35H2O于40-45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图甲所示。
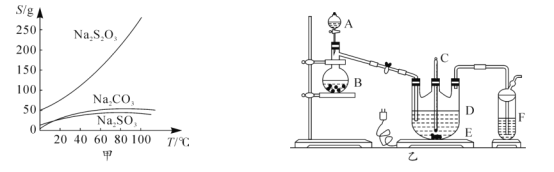
Ⅰ.制备Na2S2O35H2O
将硫化钠和碳酸钠按反应要求比例放入图乙装置D中,然后注入150mL蒸馏水使其溶解,再在分液漏斗A中注入一定浓度的H2SO4,在蒸馏烧瓶B中加入亚硫酸钠固体,并按图乙安装好装置。
(1)仪器D的名称为______
(2)打开分液漏斗活塞,注入H2SO4,使反应产生的气体较缓慢均匀地通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,总反应方程式为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。
3Na2S2O3+CO2。
①烧瓶B中发生反应的化学方程式为______。
②将B中产生的气体缓慢均匀地通入D中的正确操作是______。
③制备过程中仪器D中的溶液要控制在弱碱性条件下,其理由是______(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量

(3)操作I为趁热过滤,其目的是______;操作Ⅱ是过滤、洗涤、干燥,其中洗涤操作时用______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液中有少量晶体析出为止,蒸发时控制温度不宜过高的原因是______。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,称取1.25g的粗样品溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.0100mol/L标准I2溶液滴定,当溶液中S2O32-全部被氧化时,消耗碘溶液的体积为25.00mL.试回答:(提示:I2+2S2O32-═2I-+S4O62-)
①达到滴定终点时的现象:______
②产品中Na2S2O35H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某恒容密闭容器中进行反应X(g) + 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A. c1:c2 = 1:3
B. 当4v(X)正= v(Y)逆时,该反应还在向正反应方向建立平衡
C. c1可能为0.1
D. X、Y的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物已省略)。
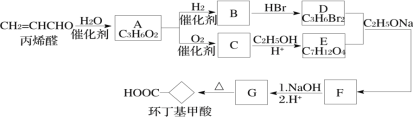
已知:
(1)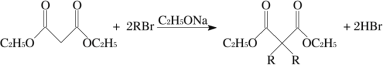
(2)![]()
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________。
(2)化合物C的结构简式是________________________。
(3)下列说法中正确的是___________(填字母代号)。
A.丙烯醛可以发生银镜反应 B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4 D.1mol化合物B与足量金属钠反应能生成1mol氢气
(4)写出D+E→F的化学方程式:__________________________________________。
(5)符合下列条件的G的同分异构体有____________种,写出其中在1H-NMR谱上显示两组峰且面积比为3∶1的结构简式:______________________。
①能使Br2/CCl4溶液褪色;②1mol G与1mol Na2CO3反应可以生成1mol CO2
(6)以1,3-丁二烯和化合物E为原料可制备![]() ,请选用必要的试剂设计合成路线____________________。
,请选用必要的试剂设计合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中错误的是
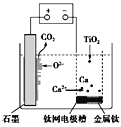
A. 在制备金属钛前后,整套装置中CaO的总量保持不变
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子
D. 若用铅蓄电池作供电电源,“—”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家在合成氨(N2+3H2![]() 2NH3 △H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
2NH3 △H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
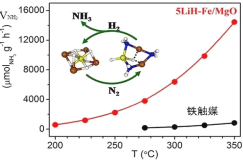
A.过程中有极性键形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.350℃,催化效率:5LiH-Fe/MgO>铁触媒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:

①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)___________。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com