
分析 4min时,测得D的浓度为0.5mol/L,则生成的n(D)=c(D)V=0.5mol/L×2L=1mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量之比等于其计量数之比,则参加反应的n(A)=$\frac{3}{2}$n(D)=$\frac{3}{2}$×1mol=1.5mol,参加反应的n(B)=$\frac{1}{2}$n(D)=$\frac{1}{2}$×1mol=0.5mol,设原来A、B的物质的量都是amol,因为容器体积相同,则4min时A、B的物质的量浓度之比等于其物质的量之比,c(A):c(B)=$\frac{(a-1.5)mol}{(a-0.5)mol}$=3:5,a=3,4min时剩余A的物质的量=3mol-1.5mol=1.5mol,则此时A的浓度=$\frac{n}{V}$;
则v(D)=$\frac{△c(D)}{△t}$=$\frac{0.5mol/L-0}{4min}$=0.125mol/(L.min),同一可逆反应中同一段时间内参加反应的各物质的化学反应速率之比等于其计量数之比.
解答 解:4min时,测得D的浓度为0.5mol/L,则生成的n(D)=c(D)V=0.5mol/L×2L=1mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量之比等于其计量数之比,则参加反应的n(A)=$\frac{3}{2}$n(D)=$\frac{3}{2}$×1mol=1.5mol,参加反应的n(B)=$\frac{1}{2}$n(D)=$\frac{1}{2}$×1mol=0.5mol,设原来A、B的物质的量都是amol,因为容器体积相同,则4min时A、B的物质的量浓度之比等于其物质的量之比,c(A):c(B)=$\frac{(a-1.5)mol}{(a-0.5)mol}$=3:5,a=3,4min时剩余A的物质的量=3mol-1.5mol=1.5mol,则此时A的浓度=$\frac{n}{V}$=$\frac{1.5mol}{2L}$=0.75mol/L;
则v(D)=$\frac{△c(D)}{△t}$=$\frac{0.5mol/L-0}{4min}$=0.125mol/(L.min),同一可逆反应中同一段时间内参加反应的各物质的化学反应速率之比等于其计量数之比,C、D的平均反应速率相等,则其计量数相等,x为2,
故答案为:0.75 mol/L;2.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,明确反应中各个物理量的关系是解本题关键,注意平均反应速率之比与计量数之比的关系,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 德国化学家维勒第一次人工合成了尿素,从而揭开了人工合成有机物的序幕 | |
| B. | 中国化学家侯德榜成功发明了侯氏制碱法,打破了外国当时对中国的相关技术封锁 | |
| C. | 英国科学家卢瑟福根据α粒子散射实验提出了“葡萄干面包式”原子结构模型 | |
| D. | 俄国化学家门捷列夫在前人基础上研究提出了元素周期律并列出了第一张元素周期表 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁粉与50mL 4mol•L-1盐酸反应,转移电子的数目为0.15NA | |
| B. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| C. | 常温常压下,16g O2和O3混合气体中含有的氧原子数为NA | |
| D. | 1mol•L-1 AlCl3溶液中含有的Cl-数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
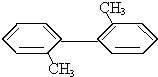
| A. | 该烃是苯的同系物 | |
| B. | 该烃分子中至少有9个碳处于同一平面上 | |
| C. | 该烃分子中的所有原子有可能处于同一平面上 | |
| D. | 该烃的一氯代物最多有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
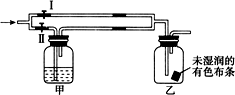 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com