
在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4,用惰性电极电解此溶液,通电片刻,则氧化产物与还原产物的质量比为()
A. 8:1 B. 16:207 C. 71:2 D. 108:35.5
考点: 电解原理.
专题: 电化学专题.
分析: 等物质的量的这些离子加入到水中,Ag+和Cl﹣结合为AgCl沉淀,Ba2+ 和SO42﹣结合为BaSO4沉淀,溶液中就只有Na+、NO3﹣了,实际上是电解NaNO3溶液,阳极上氢氧根离子放电,阴极上氢离子放电,则氧化产物是氧气,还原产物是氢气.
解答: 解:等物质的量的这些离子加入到水中,Ag+和Cl﹣结合为AgCl沉淀,Ba2+ 和SO42﹣结合为BaSO4沉淀,溶液中就只有K+、Na+、NO3﹣了,实际上是电解NaNO3溶液,阳极上氢氧根离子放电,阴极上氢离子放电,则氧化产物是氧气,还原产物是氢气,当转移相同电子时,氧化产物和还原产物的质量之比为32:(2×2)=8:1,
故选:A.
点评: 本题考查了电解池原理和离子共存,明确溶液中的溶质是解本题关键,很多学生只是根据离子放电顺序确定阴阳极上产物,因为漏掉了离子共存而导致错误,为易错题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将Fe(OH)3胶体与BaCl2的混合液装在半透膜中,浸泡在装有蒸馏水的烧杯中,过一段时间后,取烧杯中液体进行实验,能证明半透膜有破损的是()
A. 溶液为黄色
B. 能产生丁达尔效应
C. 加入AgNO3 溶液产生白色沉淀
D. 加入Na2SO4 溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe,I2,他们使用的药品和装置如如所示.
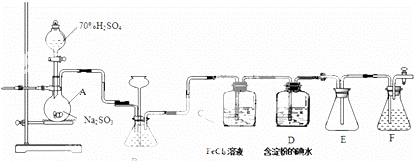
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好.装置E的作用是 .装置F中为NaOH溶液.
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是 (填离子符号).
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是方案①,原因是 .
(5)能表明I﹣的还原性弱于SO2的现象是 ,写出有关离子方程式: ﹣.
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合液中含溶质MgCl2的物质的量为 ,
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为 .
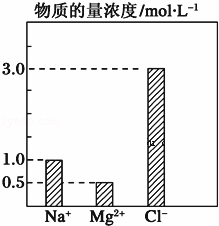
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg﹣AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg=Mg2++2Ag+2Cl﹣.有关该电池的说法正确的是()
A. Mg为电池的正极 B. 负极反应为AgCl+e﹣=Ag+Cl﹣
C. 不能被KCl 溶液激活 D. 可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,
(1))请写出NO2和CO反应的热 化学方程式: 已知:N2 (g)+2NO2 (g)⇌4NO(g)△H=+292.3kJ•mol﹣1,
化学方程式: 已知:N2 (g)+2NO2 (g)⇌4NO(g)△H=+292.3kJ•mol﹣1,
则反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) 的△H= ;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)⇌2N2O5(g);已知体系中n(NO2)随时间变化如表:
t(s) 0 500 1000 1500
N(NO2)(mol) 20 13.96 10.08 10.08
写出该反应的平衡常数表达式:K= ,
已知:K3000C>K3500C,则该反应是 反应(填“放热”或“吸热”).

查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1mol C10H22含共价键数目32NA
B. 常温常压下,8g CH4含有电子数目5NA
C. 1L 0.1mol•L﹣1的醋酸溶液中含有CH3COO﹣的数目0.1NA
D. 78g苯含有C=C双键的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,10s 内A的反应速率为0.12mol/(L•s),10s后容器内的B的物质的量为()
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com