
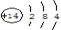 ,故答案为:
,故答案为: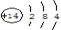 ;
;
| ||
| ||
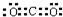 ,Y为CO2,二者反应生成碳酸钠和氧气,该反应为2Na2O2+2CO2=2Na2CO3+O2,2molNa2O2反应转移2mol电子,当反应中有3.01×1023个电子转移时,即0.5mol电子转移参加反应的二氧化碳为0.5mol,所以参加反应的Y的质量是0.5mol×44g/mol=22g,
,Y为CO2,二者反应生成碳酸钠和氧气,该反应为2Na2O2+2CO2=2Na2CO3+O2,2molNa2O2反应转移2mol电子,当反应中有3.01×1023个电子转移时,即0.5mol电子转移参加反应的二氧化碳为0.5mol,所以参加反应的Y的质量是0.5mol×44g/mol=22g,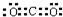 ;2Na2O2+2CO2=2Na2CO3+O2;22.
;2Na2O2+2CO2=2Na2CO3+O2;22.


科目:高中化学 来源: 题型:
| A、利用植物油的加成反应可以制得人造黄油 |
| B、75%的酒精可使蛋白质变性从而起到消毒作用 |
| C、纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 |
D、可用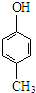 和HCHO为原料合成 和HCHO为原料合成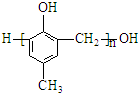 |
查看答案和解析>>
科目:高中化学 来源: 题型:

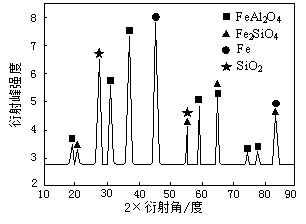
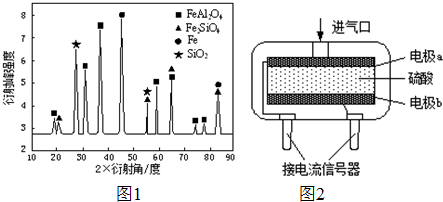
查看答案和解析>>
科目:高中化学 来源: 题型:
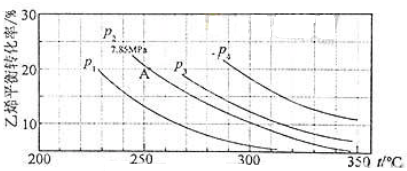
查看答案和解析>>
科目:高中化学 来源: 题型:
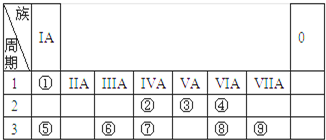
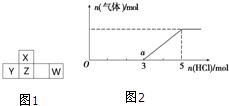 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
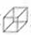 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: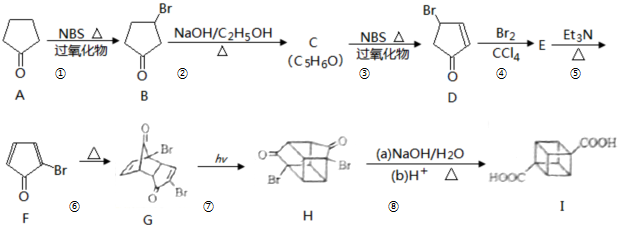

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、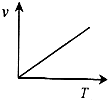 |
B、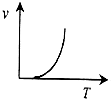 |
C、 |
D、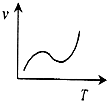 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com