
| A. | Fe跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | Fe跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | FeCl3与Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3跟硝酸反应:Fe(OH)3+3H+═Fe3++3H2O |
分析 A.电荷不守恒;
B.不符合反应客观事实;
C.电荷不守恒;
D.二者反应生成硝酸铁和水.
解答 解:A.Fe跟FeCl3溶液反应:Fe+2Fe3+═3Fe2+,故A错误;
B.Fe跟稀硫酸反应,离子方程式:Fe+2H+═Fe2++H2↑,故B错误;
C.FeCl3与Cl2反应,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故D错误;
D.Fe(OH)3跟硝酸反应,离子方程式:Fe(OH)3+3H+═Fe3++3H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应应遵循客观事实、遵循原子个数守恒规律,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
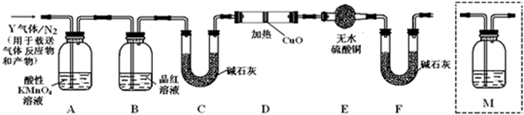
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3化合反应 | |
| B. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ 分解反应 | |
| C. | CuO+CO═Cu+CO2 置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向烧碱液中通入过量的二氧化碳:2OH-+CO2═CO32-+H2O | |
| B. | 向纯碱溶液通入足量的二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| C. | 向硅酸钠水液中通人少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通人少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
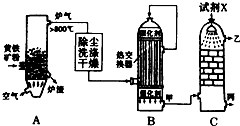 合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:
合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冶炼金属钠通常用电解氯化钠溶液的方法 | |
| B. | 要使海水淡化通常有蒸馏法和离子交换法 | |
| C. | 用氯气和氢氧化钠制漂白粉 | |
| D. | 工业冶炼金属铁用铝和三氧化二铁高温下发生铝热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com