
1200℃时可用反应 2BBr3(g)
+ 3H2(g)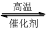 2B(s)
+ 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s)
+ 6HBr(g) 来制取晶体硼。完成下列填空:
(1)下列说法能说明该反应达到平衡的是______(选填序号,下同)。
a. v正(BBr3)= 3v逆(HBr) b. 2c(H2) = c(HBr)
c.密闭容器内压强不再变化 d. 容器内气体平均摩尔质量不再变化
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,下列说法正确的是_________。
a. 在平衡移动时正反应速率先增大后减小
b. 在平衡移动时逆反应速率始终增大
c. 正反应为放热反应
d. 达到新平衡后反应物不再转化为生成物
(3)若上述反应在10L的密闭容器内反应,5min后,气体总质量减少1.1 g,则该时间段内氢气的平均反应速率为__________________。
(4)往容器中充入0.2 mol BBr3和一定量H2,充分反应达到平衡后,混合气体中HBr百分含量与起始通入H2的物质的量有如图关系。在a、b、c三点中,H2 的转化率最高的是______(选填字母)。b点达到平衡后,再充入H2使平衡到达c点,此过程中平衡移动的方向为__________(填“正向”、“逆向”或“不移动”)。

(本题共8分)(1) cd(2分);(2)ab(2分);
(3)0.003mol/(L·min)(2分);(4)a(1分),正向(1分)
【解析】
试题分析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.v正(BBr3)=3v逆(HBr),说明二者的反应速率方向相反,但不能满足反应速率之比是相应的化学计量数之比,应该是3v正(BBr3)=v逆(HBr)时可以说明,a不正确;b.2c(H2)=c(HBr)满足反应速率之比是相应的化学计量数之比,但不能确定反应的方向,因此不一定能说明,b不正确;c.反应是体积增大的可逆反应,因此当密闭容器内压强不再变化时可以说明反应达到平衡状态,c正确;d.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是变化的,所以容器内气体平均摩尔质量不再变化时可以说明达到平衡状态,d正确,答案选cd。
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,这说明平衡向正反应方向移动,因此正方应是吸热反应。a.升高温度,平衡向正反应方向移动,所以在平衡移动时正反应速率先增大后减小,a正确;b. 升高温度,平衡向正反应方向移动,所以在平衡移动时逆反应速率始终增大,b正确;c.正反应为吸热反应,c不正确;d.达到新平衡后正逆反应速率相等,但不为0,所以反应物不再转化为生成物是错误的,d不正确,答案选ab。
(3)根据方程式可知:2BBr3(g) + 3H2(g) 2B(s)
+ 6HBr(g) △m↓
2B(s)
+ 6HBr(g) △m↓
3mol 22g
0.15mol 1.1g
因此消耗氢气的浓度是0.15mol÷10L=0.015mol/L
所以氢气的反应速率=0.015mol/L÷5min=0.003mol/(L·min)
(4)在BBr3的物质的量固定的条件下,氢气的量越多,BBr3的转化率越高而氢气的转化率越低,因此根据图像可知,氢气转化率最高的是a点;b点达到平衡后,再充入H2使平衡到达c点,增大反应物浓度平衡向正反应方向越低,因此在此过程中平衡移动的方向为正向。
考点:考查可逆反应平衡状态判断、外界条件对反应速率和平衡状态的影响、反应速率计算以及图像识别等


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
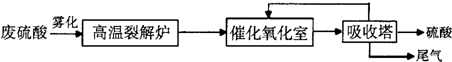
| 500-850℃ |
| 雾化后废硫酸液滴直径 | 废硫酸完全裂解所需时间 | |
| 普通雾化器 | 800-1200/μm | 10s以上 |
| 旋转式雾化器 | 600-850 μm | 8-10s |
| 压缩风雾化器 | 400-650 μm | 6-7s |
| 超声波雾化器 | 100-300μm | 3.5-5s |
查看答案和解析>>
科目:高中化学 来源:上海市虹口区2013年高考一模化学试题 题型:022
1200℃时可用反应2BBr3(g)+3H2(g)![]() 2B(s)+6HBr(g)来制取晶体硼.完成下列填空∶
2B(s)+6HBr(g)来制取晶体硼.完成下列填空∶
1.下列说法能说明该反应达到平衡的是________(选填序号,下同).
a.v正(BBr3)=3v逆(HBr)
b.2c(H2)=c(HBr)
c.密闭容器内压强不再变化
d.容器内气体平均摩尔质量不再变化
2.若密闭容器体积不变,升高温度,晶体硼的质量增加,下列说法正确的是________.
a.在平衡移动时正反应速率先增大后减小
b.在平衡移动时逆反应速率始终增大
c.正反应为放热反应
d.达到新平衡后反应物不再转化为生成物
3.若上述反应在10 L的密闭容器内反应,5 min后,气体总质量减少1.1 g,则该时间段内氢气的平均反应速率为________.
4.往容器中充入0.2 mol BBr3和一定量H2,充分反应达到平衡后,混合气体中HBr百分含量与起始通入H2的物质的量有如图关系.

在a、b、c三点中,H2的转化率最高的是________(选填字母).
b点达到平衡后,再充入H2使平衡到达c点,此过程中平衡移动的方向为________(填“正向”、“逆向”或“不移动”).
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:实验题
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收
K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:

已知:①Cr(OH)3+OH-=CrO2-+2H2O;
②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250mL 6 mol·L-1 的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有 。
(2)由于含铬废液中含有少量的K2Cr2O7,抽滤时可用 代替布氏漏斗;抽滤过程
中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为 。
(3)滤液Ⅰ酸化前,进行加热的目的是 。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是 。
(4)下表是相关物质的溶解度数据:
|
物质 |
0℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
|
KCl |
28.0 |
34.2 |
40.1 |
45.8 |
51.3 |
56.3 |
|
K2SO4 |
7.4 |
11.1 |
14.8 |
18.2 |
21.4 |
24.1 |
|
K2Cr2O7 |
4.7 |
12.3 |
26.3 |
45.6 |
73.0 |
102.0 |
|
KNO3 |
13.9 |
31.6 |
61.3 |
106 |
167 |
246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为① 、② 。
(5)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为 (设整个过程中其它杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将: (填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com