
【题目】已知草酸为二元弱酸:H2C2O4 ![]() HC2O4-+ H+ Ka 1 ; HC2O4-
HC2O4-+ H+ Ka 1 ; HC2O4- ![]() C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
A.常温下,Ka1 :Ka2 =1000
B.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得 pH为4.2的混合液
C.pH=1.2 溶液中:c(K + ) + c(H + ) = c(OH-) + c(H2C2O4)
D.向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
【答案】B
【解析】A.电离平衡常数Ka 1 =[H+][HC2O4-]÷[H2C2O4]=10-1..2 , Ka 2=[H+][C2O42-]÷[HC2O4-]=10-4.2 , Ka 1 :Ka 2=1000,A项不符合题意;
B.pH=4.2时,[HC2O4-]、[C2O42-]的浓度相等,而相同物质的量 KHC2O4 和 K2C2O4 固体完全溶于水得到的溶液, HC2O4-和C2O42-的水解程度不同,离子浓度不再相等,B项符合题意;
C.pH=1.2溶液中,存在电荷守恒c(K + ) + c(H + ) = c(OH-) + c(HC2O4-),c(HC2O4-)=c(H2C2O4),则c(K + ) + c(H + ) = c(OH-) + c(H2C2O4),C项不符合题意;
D.随着KOH溶液的加入,HC2O4-的浓度逐渐减少,C2O42-的浓度增大,而HC2O4-的水解程度小于C2O42-的水解程度,盐的水解促进水的电离,所以向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大,D项不符合题意;
答案选B。A.根据电离平衡常数的定义进行计算;
B.结合图中pH与离子浓度的关系进行判断;
C.根据电荷守恒进行判断;
D.根据离子浓度的变化与水解程度的大小关系进行分析即可。


科目:高中化学 来源: 题型:
【题目】有关下图所示化合物的说法不正确的是 ( ) 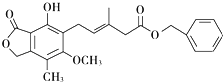
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1mol该化合物最多可以与3molNaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是
A. 胶体是一种介稳体系 B. 胶体中分散质粒子的直径小于1 nm
C. 利用丁达尔效应可以区分溶液和胶体 D. 用滤纸能分离胶体和悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=﹣53.7kJmol﹣1 Ⅰ
CO2(g)+H2(g)CO(g)+H2O(g)△H2 Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为﹣283.0kJmol﹣1和﹣285.8kJmol﹣1 .
②H2O(1)═H2O(g)△H3=44.0kJmol﹣1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=;反应Ⅱ的△H2=kJmol﹣1 .
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 .
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 .
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程﹣能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示.A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素.下列说法不正确的是( )
A.简单离子的半径大小关系:B>C>E
B.D,E两种元素形成的化合物,可能含有离子键和共价键
C.A,B,C三种元素形成的化合物,晶体类型一定相同
D.B,D分别和C形成的化合物,都有可能使溴水或品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验步骤补全实验结论。
实验步骤 | 解释或实验结论 |
① 称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: |
② 将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | ②A的分子式为: . |
③ 另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况) | ③A中官能团的结构简式: 、 |
④ A的核磁共振氢谱如图: | ④A中含有 种氢原子 |
⑤ 综上所述,A的结构简式 . | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1000 mL某待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种如下表,现进行如下实验操作(每次实验所加试剂均过量):
阳离子 | K+、NH |
阴离子 | Cl-、Br-、CO |

(1)写出生成白色沉淀B的离子方程式:_________。
(2)待测液中肯定不存在的阳离子是_______。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在____(填“是”或“否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | CaCO3 | NaCl | HNO3 |
弱电解质 | CH3COOH | H3PO4 | NH3 | Fe(OH)3 |
非电解质 | 蔗糖 | 酒精 | BaSO4 | Al2O3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com