
(12分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。 用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为____________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是_________________(写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________ __。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
科目:高中化学 来源: 题型:阅读理解
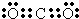
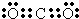
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省厦门六中高一下学期期中考试化学试卷 题型:填空题
(8分)X、Y、Z、W、L、M六种主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数 是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)Y的最高价氧化物的电子式为 ;
(2)X 与M形成的化合物名称为 ;
(3)Z的最高价氧化物对应水化物的溶液与W的最高价氧化物反应的离子方程式为:
;
(4)R与Y同周期,1个R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,这种新型无机非金属材料的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2012届北京市101中学高三下学期开学检测化学试卷 题型:填空题
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)M在元素周期表中的位置为 。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 (写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)写出Z的最高价氧化物对应的水化物与单质W反应的离子方程式为
。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是 。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省四地六校高一下学期第三次月考化学试卷(带解析) 题型:填空题
(7分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。
用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为__________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是_________________________。
(3)Y的最高价氧化物的电子式为__________。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是_________________。
(4)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三上学期期末检测化学试卷 题型:填空题
(12分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。 用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为____________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是__________________________(写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________ __。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: IO3-+ 5I-+ 6H+ == 3 I2 + 3 H 22O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是_________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com