
分析 (1)含有半满p轨道的最轻原子,其最外层电子为s22p3,为N元素;
(2)最活泼的非金属元素为F元素;
(3)第一电离能最大的元素为稀有气体He元素;
(4)3d轨道半充满的元素的原子,其外围电子排布为:3d54s1或3d54s2,是Cr元素或Mn元素.
解答 解:(1)含有半满p轨道的最轻原子,其最外层电子为s22p3,为N元素,原子序数为7,其电子排布式为:1s2s22p3;
故答案为:1s2s22p3、7、氮;
(2)最活泼的非金属元素为F元素,原子序数为7,电子排布式为1s22s22p5;
故答案为:1s22s22p5、9、氟;
(3)第一电离能最大的元素为稀有气体He元素,其原子序数为2,电子排布式为1s2;
故答案为:1s2、2、氖;
(4)3d轨道半充满的元素的原子,其外围电子排布为:3d54s1,是铬元素,其原子序数为24,电子排布式为:1s22s22p63s23p63d54s1;外围电子排布为3d54s2,Mn元素,原子序数为25,其电子排布式为:1s22s22p63s23p63d54s2;
故答案为:1s22s22p63s23p63d54s1、24、铬或者1s22s22p63s23p63d54s2、25、锰.
点评 本题考查了基态原子的核外电子排布式,根据核外电子排布规律来写,注意电子处于全满、半满、全空时最稳定,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向30mL0.1mol•L-1NaOH溶液滴加20mL0.1mol•L-1H2C2O4溶液后:3c(Na+)=2[c(HC2O${\;}_{4}^{-}$)+c(C2O${\;}_{4}^{2-}$)+c(H2C2O4)] | |
| B. | 将同浓度的CH3COONa溶液和HCl溶液按照体积比2:1混合,混合后溶液呈酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 向NH4HSO4溶液中加入NaOH至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)═c(NH${\;}_{4}^{+}$) | |
| D. | 常温下将pH为3的CH3COOH溶液与pH为11的NaOH溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3 | B. | ${\;}_{1}^{2}$H和${\;}_{1}^{2}$H | ||
| C. | 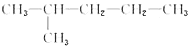 和CH3-CH2-CH2-CH2-CH2-CH3 和CH3-CH2-CH2-CH2-CH2-CH3 | D. | CH3-CH2-CH3和CH3-CH2-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
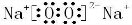 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
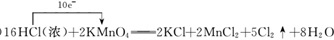 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
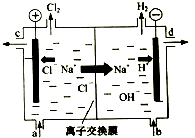 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com