
【题目】下列操作中,能使电离平衡H2O![]() H++OH-,向右移动且溶液呈酸性的是 ( )
H++OH-,向右移动且溶液呈酸性的是 ( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
【答案】B
【解析】
能使电离平衡H2O![]() H++OH-向右移动,说明加入的物质能和氢离子或氢氧根离子反应而促进水的电离;溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性。
H++OH-向右移动,说明加入的物质能和氢离子或氢氧根离子反应而促进水的电离;溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性。
A、硫酸氢钠的电离:NaHSO4═Na++H++SO42-,溶液中氢离子浓度增大,水的电离平衡逆向移动,故A错误;
B、向水中加入硫酸铝,铝离子水解而促进水电离,且溶液呈酸性,故B正确;
C、向水中加入碳酸钠溶液,碳酸根离子水解促进水的电离,碳酸根离子和氢离子结合生成碳酸氢根离子而使溶液中氢氧根离子浓度大于氢离子浓度,所以溶液呈碱性,故C错误;
D、升高温度,水的电离程度增大,但是溶液中氢离子浓度等于氢氧根离子浓度,溶液显示中性,故D错误;
故选:B。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】(1)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:_____。

(2)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)═2H2O(l)。请回答下列问题:
①该反应的生成物能量总和____(填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量____(填“大于”、“小于”或“等于”)572kJ。
(3)已知拆开1molN﹣N键、1molN﹣H键、1molN≡N键、O=O键需要的能量分别是3akJ、2.5akJ、8akJ、4akJ,完全燃烧1mol火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则1molH2O(g)完全断键时共吸收____kJ的能量。
(4)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,反应物的总键能_____(填“大于”、“小于”或“等于”)生成物的总键能。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B. 反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
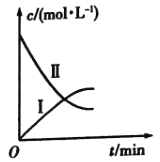
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的
A.甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)△H=-890 kJ/mol
B.在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H=-158.4kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1
C.NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
(1)该反应的平衡常数表达式为K=________。
(2)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为________。
(3)该反应达到平衡后,加入Fe粉,平衡________移动;保持恒温恒容通入CO,平衡向________移动。(填“向左”、“向右”或“不”)
(4)表明该反应已达平衡状态的是______________
A.单位时间内生成nmolCO同时生成nmolCO2 B.恒容时混合气体的压强不变
C.混合气体的总质量不变 D.CO2的体积分数不变 E.Fe的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国谚语与古籍中,有许多关于化学变化的记载。例如,谚语“雷雨发庄稼”;《淮南万毕术》中记载“曾青得铁则化为铜”,以上例子不涉及的反应是( )
A.N2+O2![]() 2NOB.Zn+Fe2+=Zn2++Fe
2NOB.Zn+Fe2+=Zn2++Fe
C.Fe+Cu2+=Fe2++CuD.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )

A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
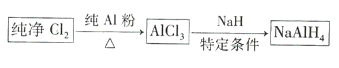
【题目】氢化铝钠![]() 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
某实验小组利用如图所示的装置制备无水![]() 。
。
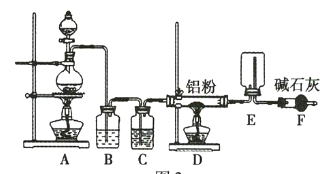
(1)装置F的作用是 _____________________________ 。
(2)![]() 与NaH反应时,需将
与NaH反应时,需将![]() 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为 _____________________________
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。
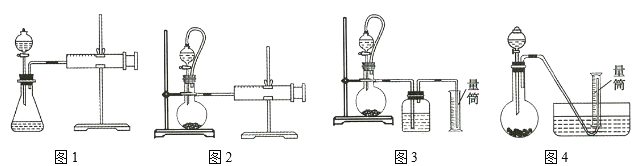
从简约性、准确性角度考虑,最适宜的装置是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com