
分析 (1)碳酸钠氢钠性质不稳定受热分解生成稳定的碳酸钠;
(2)碳酸钠溶液中通入二氧化碳生成碳酸氢钠;
(3)氯气与氯化亚铁反应色生成氯化铁;
(4)氯化铁与铁反应生成氯化亚铁;
(5)氯化氢与饱和亚硫酸氢钠溶液反应生成氯化钠、二氧化硫和水;
(6)铝能够与氢氧化钠溶液反应生成可溶性偏铝酸盐,镁与氢氧化钠溶液不反应;
解答 解:(1)碳酸钠氢钠性质不稳定受热分解生成稳定的碳酸钠,所以加热可以除去碳酸钠中碳酸氢钠方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)碳酸钠溶液中通入二氧化碳生成碳酸氢钠,据此可以除去碳酸氢钠中碳酸钠,离子方程式:CO32-+H2O+CO2=2HCO3-;
故答案为:CO32-+H2O+CO2=2HCO3-;
(3)氯气与氯化亚铁反应色生成氯化铁,向氯化亚铁溶液中通入氯气可以除去氯化铁中的氯化亚铁,离子方程式:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)氯化铁与铁反应生成氯化亚铁,所以向氯化铁溶液中加入铁粉可以除去氯化亚铁中的氯化铁,离子方程式:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
(5)氯化氢与饱和亚硫酸氢钠溶液反应生成氯化钠、二氧化硫和水,二氧化硫在饱和亚硫酸氢钠溶液中溶解度不大,所以用饱和亚硫酸氢钠洗气可以除去二氧化硫中的氯化氢,离子方程式:HSO3-+H+=H2O+SO2↑;
故答案为;HSO3-+H+=H2O+SO2↑;
(6)铝能够与氢氧化钠溶液反应生成可溶性偏铝酸盐,镁与氢氧化钠溶液不反应,所以用氢氧化钠溶液可以除去镁中的铝,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题为物质除杂题,进行物质除杂时,可以根据物质的性质,采用物理或化学的方法除去,注意除杂原则不能引入新的杂质,题目难度不大.


科目:高中化学 来源: 题型:解答题
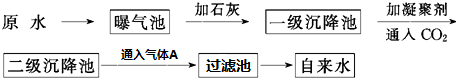
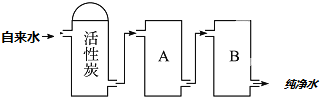
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察K2SO4溶液的颜色 | |
| B. | 加水稀释CuSO4溶液,溶液颜色变浅 | |
| C. | 向CuSO4溶液中滴加过量NaOH溶液,振荡后静置,溶液变成无色 | |
| D. | 向CuSO4溶液中滴加过量Ba(NO3)2溶液,振荡后静置,溶液未变成无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2气体通入三氯化铁溶液中:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+ | |
| B. | 铜和三氯化铁溶液反应:Cu+Fe3+=Fe2++Cu2+ | |
| C. | 实验室制取氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 金属铝投入到NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
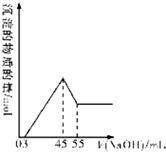 准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示:
准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 若反应完全后溶液的体积仍为100mL,则溶液的pH约为14 |
| C | 50mL H2O | c(Na+)=2[c(CO32-)+c(HCO3-)] |
| D | 0.1mol NaHSO4 | 反应完全后,溶液pH减小,c (Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com