
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| D. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
分析 A.将废电池深埋,能够引起土壤污染;
B.反应是否放热、吸热与反应条件无关;
C.可燃冰(固态甲烷水合物)可作燃料;
D.太阳能、风能和氢能为清洁能源,可减少环境污染.
解答 解:A.将废电池深埋,能够引起土壤污染,不利于环境保护,故A错误;
B.反应是否放热、吸热与反应条件无关,如铝热反应为放热反应,但需要在高温下反应,故B错误;
C.可燃冰(固态甲烷水合物)可作燃料,合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺,但这不是缓解能源紧缺的唯一途径,开发氢能、地热能、风能等都有助于缓解能源紧缺,故C错误;
D.开发太阳能、风能和氢能等洁净能源可减少化石燃料的使用,减少污染物的排放,故D正确;
故选D.
点评 本题考查了化学知识在生活实际的应用,涉及环境污染与治理、能源的开发与利用,题目难度不大,注意对相关知识的积累.


科目:高中化学 来源: 题型:解答题
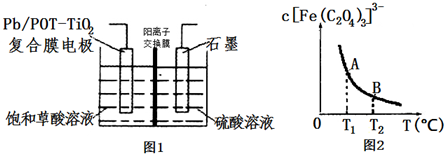
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
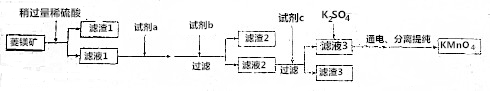
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
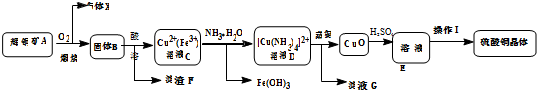

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml0.1mol/L HCl溶液混合后溶液呈酸性,所得溶中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| B. | H2O2、Na202、SO2都具有漂白性且漂白原理相同 | |
| C. | 饱和Na2C03溶液中通入CO2溶液会变浑浊 | |
| D. | 可用石灰水吸收尾气中的S02气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com